理化学研究所(理研)は1月25日、マウスを用いて「体細胞クローン胚」の発生開始から着床期直前まで生きたまま連続観察する技術を開発し、クローン作製成功率の低い決定的な要因の1つが、「初期卵割」(受精や人工的な刺激により発生を開始した胚が起こす体細胞分裂)過程における「染色体分配異常」(ACS:Abnormal chromosome Segregation)であることを実験で突き止めたと発表した。理研発生・再生科学総合研究センターゲノム・リプログラミング研究チームの山縣一夫研究員(現大阪大学・微生物病研究所特任准教授)、水谷英二研究員(現理研BRC遺伝工学基盤技術室協力研究員)らによる成果で、米科学雑誌「Developmental Biology」に最終版が近日掲載される予定。
体細胞クローン技術とは、体細胞から個体を作りだす技術であり、絶滅動物、絶滅危惧種の復活や保存、畜産・医療分野における有用家畜の効率的な生産、さらには基礎生物学における核の初期化メカニズムの研究への応用も期待されている。しかし、1997年に世界で初めて哺乳類の体細胞クローンとなるクローン羊「ドリー」の作製が報告されてから15年以上経つが、その成功率は未だに低いままだ。
これまでに研究チームは、体細胞クローン胚のゲノムの状態を正常化することで、作製効率の向上に成功していたが、正常胚レベルにまで改善したとはいえず、そのほかにも大きな原因があると考えられていた。
なお、体細胞クローン胚とは、あらかじめ核を取り除いた卵子にドナーとなる体細胞の核を入れ替えて作った胚のことで、この胚が発生すれば、ドナー細胞と同じ遺伝子を持つ子ども(クローン)が産まれるというわけだ。
これまで原因が特定できなかった主な理由に、実験手法の難しさがある。まず、クローンに用いる体細胞核移植自体、熟練した技術が必要だ。卵子は培養細胞とは異なり増えないので、物質を抽出して解析するような生化学的・分子生物学的手法を用いるのは困難である。
また、染色法のような細胞を固定・破壊してしまう解析方法では、ある時点での体細胞クローン胚が異常を示しても、その後の発生過程を追えないのでそれがどのように個体発生に影響するのかがわからないという欠点を持つ。さらに、同一の体細胞クローン胚であっても個々の性質が少しずつ異なっており、そのうち個体にまで発生できるものはごく一部だ。従って、複数の胚を混ぜてしまう解析では意味がないという。
体細胞クローン技術では、分化した細胞である体細胞核の情報が卵子の中でリセットされ、通常の受精卵のようなまっさらな状態に戻ると考えられている。このリセットを初期化というが、その実態は未だに不明な部分が多い。この過程で起きている何らかの失敗、すなわち初期化異常が体細胞クローン作製の成功率が低い原因と考えられている。よって、その作製成功率が低い主な原因を探るためには、体細胞クローン胚を1つずつ識別し、胚発生開始から産仔まで追跡し続ける必要があるというわけだ。
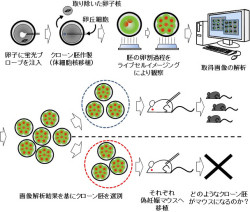
そこで研究チームは、オワンクラゲ由来の蛍光タンパク質を目的とするタンパク質と結合させた蛍光プローブを作製してそれを細胞内に導入し、細胞内の分子や構造の時間変化を生きたまま観察する「ライブセルイメージング」技術を用いて、1つひとつの体細胞クローン胚を発生開始から着床期直前まで連続的に観察。その後、その胚を個別に移植することで、観察した現象と作製率を直接結びつけた解析ができると考察し、解析対象として、近年、生殖医療分野において不妊の主な原因と指摘されている胚の染色体の異常性に着目した。
ライブセルイメージング技術を用いたのは、サンプルに対して繰り返し紫外線などの光を照射する従来のイメージング技術では、観察後の細胞が死んでしまうという大きな欠点を有しているためだ。できる限り体細胞クローン胚を傷つけないイメージング技術の構築に挑んだのである。
研究グループは、雌マウスから採取した未受精卵に、核・染色体は赤色に、紡錘体(細胞分裂の際に染色体の周りに形成され、染色体分配を行う細胞内構造)は緑色にそれぞれ染める蛍光プローブを注入。その後に卵子の核を除き、代わりに「卵丘細胞」由来の細胞核を注入した(体細胞核移植)。
卵丘細胞とは、卵子を取り囲んでいる顆粒層細胞のことで、卵子とはゆるく結合しており、卵子の成熟、生存に重要な役割を果たしている細胞だ。採卵時に卵子とともに採取できる体細胞であるため、ドナー細胞としてクローン研究によく用いられる。
そして、発生開始後に研究チームが開発したライブセルイメージング技術を使って桑実胚(マウスの場合は発生開始から3日目ほど進んだ状態で、おおむね16細胞期に相当し、桑の実のような見た目をしている)・胚盤胞期(胚盤胞期は、さらに分裂が進んだ4日目から5日目の状態で、卵割腔と呼ばれる空洞ができ、将来体を作る内部細胞塊と胎盤を作る栄養膜細胞とに分かれる)までの3日間、連続的かつ3次元的に染色体の動きを観察し続けた。
さらに、得られた画像情報を基に1つひとつの胚についてその特徴を把握し、個別に「偽妊娠マウス」に移植して体細胞クローンマウスが産まれるかが調べられた(画像1)。偽妊娠マウスとは、精管結紮した雄マウスとの交配や電気刺激などにより、実際は妊娠していないが、妊娠したような状態になった雌マウスのことである。このマウスの卵管や子宮に体外培養した胚を移植することで産仔を得る仕組みだ。仮腹ともいわれる。
今回のライブセルイメージング技術では、蛍光タンパク質も過剰になればダメージの要因となるため、それを減らすべく胚での発現量を可能な限り少なくするとともに、励起光(レーザー)の照射を最小限にしても蛍光を最大限検出するような光学機器群を採用して開発された。
レーザー強度、露光時間、照射間隔などについても最適条件を設定。また、顕微鏡上という環境であっても温度やガス濃度などを長時間にわたって安定的に保持できるようにした。こうした改良を加え「胚発生にやさしい」イメージング技術を開発したことで、体細胞クローン胚の発生を60時間近く連続観察することに成功したのである(画像2・3)。また、解析後の胚からでもクローンマウスが産まれることも確認した。
撮影した動画を詳細に解析したところ明らかになったのが、8細胞期までの卵割過程において80%近くのクローン胚が、少なくとも1度はACSを起こしているということだ。16細胞期までに1度も異常を起こさない胚は、8.9%しかないという少なさであった(画像4~6)。
次に、このようなACSを起こした胚について、異常が起きたステージごとに区別し、それらを個別に偽妊娠マウスに移植することで、ACSが体細胞クローン作製に与える影響が検討された(図7)。
その結果、8細胞期までの卵割過程の間に1回でもACSを起こした胚からは、クローンマウスは得られなかったのである。また、8細胞期から16細胞期の間にACSを起こした胚からは2.5%、16細胞期までの間に1度も分配異常を起こさなかった胚からは7.1%の確率で産まれていることから、8細胞期までに起きるACSが、体細胞クローンを作製できない決定的な要因の1つであることが判明した次第だ。
この結果を確認するため、実験に用いた体細胞クローン胚から72個を無作為に選び、それぞれ1匹ずつの偽妊娠マウスに移植。最終的に3匹のクローンマウスが得られ、それらの基になった体細胞クローン胚の卵割過程を遡って解析した結果、いずれのクローン胚も8細胞期までACSは見られなかったのである(画像8)。
今回、開発された「胚発生にやさしいライブセルイメージング技術」により、生きた体細胞クローン胚の発生過程の解析とその作製率を直接的な相関性を持って調べることに成功し、体細胞クローン作製成功率の低い決定的な要因の1つが、ACSに起因することが証明された。
今回の技術自体も賞賛すべきものだが、これにより初期胚の段階で将来個体になる可能性があるクローン胚と致死の胚を見分けることが可能になったことも大きい。体細胞クローン作製の成功率が大幅に向上する可能性が出てきたからだ。
ACSという核や遺伝子構造レベルの大きな異常が主な原因であったという知見は、これまでの常識をくつがえす重要な結果となるという。今後、その原因を詳細に調べ、染色体の正常性を維持できるような機構の創出に結びつけていくことができれば、さらに効率的な体細胞クローンの作製につながることはいうまでもない。
また、近年の生殖医療研究の進展により、不妊の原因の多くは、初期胚の染色体安定性維持能力の低下である可能性が指摘されている。「胚発生にやさしいライブセルイメージング技術」は、生きたままの胚の染色体を評価することが可能であり、不妊の原因究明などにも応用できるため、生殖医療分野への貢献も期待できると研究グループでは説明している。