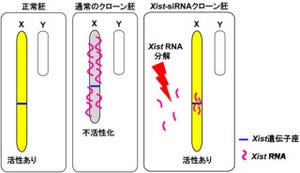
理化学研究所(理研)と名古屋大学は11月10日、内分泌器官として全身のホルモン調節で中心的な役割を果たす「下垂体」を、胚性幹細胞(ES細胞)の培養により試験管内で実現することに成功したと共同で発表した。下垂体とは、両眼の奥、頭部の正中に位置し、間脳(視床下部)の腹側に隣接する場所にある、全身に向かって各種ホルモンを放出する内分泌の中枢器官で(画像1)、まさに今回の作製は「人工下垂体」といえる。
研究は理研 発生・再生科学総合研究センター 器官発生研究グループの笹井芳樹グループディレクターや名古屋大学 大学院医学系研究科糖尿病・内分泌内科の大磯ユタカ教授らによるによるもので、科学雑誌「Nature」オンライン版に日本時間で11月10日に掲載される。
ES細胞やiPS細胞などの「多性能幹細胞」は、すべての種類の体細胞に分化する能力=多能性を有しており、試験管内で医学的に有用な細胞を産生する供給源として注目を集めている。ある種類の細胞が生体内で変成するために起きてしまうような病気に対して、ヒトES細胞やiPS細胞などから分化させた細胞を移植して治療する再生医療は、難病克服の切り札として期待されている状況だ。
研究グループが今回採った方法は、同グループがこれまでに開発してきたES細胞などから神経細胞や網膜細胞を効率よく分化させる方法として、「無血清凝集浮遊培養法(Serum-free Floating culture of Embryoid Body-like aggregates with quick reaggregation:SFEBq法)」と、そのSFEBq法を用いてES細胞から大脳皮質や網膜の立体的な組織を試験内で構築する技術だ。
なおSFEBq法とは、ES細胞などを酵素でバラバラに分散させ、それを3,000個程度の細胞の塊に再凝集させたものを分化培養の材料に用いる技術のこと。この細胞凝集塊を培養する場合、通常の細胞培養で行うような細胞を培養シャーレに接着させて培養する方法では、立体的な組織形成が損なわれて、きれいな構造体を作ることができない。そのため、培養容器を「細胞非接着性ポリマー」でコーティングし、細胞や組織が容器に付着しないようにし、細胞塊を培養液の中で浮遊させる培養方法で立体的な組織形成を可能にするというもの。SFEBq法では、血清や転写因子などの神経分化阻害効果のある成分を一切含まない特殊な培養液に浮遊させて数日培養する。この方法により、9割以上の細胞を中枢神経系の細胞に分化させることが可能になる形だ。
また、そうした体組織の形成には、ES細胞由来の大脳皮質または網膜の前駆細胞たちの間で自発的な相互作用が生まれ、組織全体で高度な形態系壊死が引き起こされる現象の「自己組織化」が観察されている。立体的な組織を自己組織化させて移植することは、個々の細胞の移植に比べて、再生医療の効果や安全性が飛躍的に増すことが期待されているところだ。
そこで、今回研究グループはSFEBq法による立体培養での自己組織化技術をさらに発展させ、ES細胞から内分泌器官である下垂体の自己組織化を試み、形成した人工下垂体のホルモン分泌機能を実証することを目指したのである。
今回の研究の成果の1つ目は「マウスES細胞の立体培養とラトケ嚢(下垂体原基)の発生環境の再現」だ。ほ乳類胚の発生過程において、下垂体本体(腺性下垂体)は胎児の口腔内の口腔外胚葉から発生する(画像2)。その発生に際しては、隣接する間脳組織(特に視床下部)から分化を促す誘導シグナルを受けることは確認済みだ。要は、口腔外胚葉と視床下部との相互作用が下垂体発生に必要な環境を生み出すというわけである。
過去の研究ではSFEBq法の培養液からすべての増殖因子を除いて培養すると、視床下部組織に分化することが確認されてたことから、マウスES細胞をSFEBq法で培養する際に、培養条件を少し変更させることで、視床下部細胞と口蓋外胚葉も分化させる方法を確立し、1つのES細胞業周塊の中で、2種類の細胞を共存させることに成功した。
ES細胞凝集塊の形成時には通常1塊当たり3000個のES細胞を用いるが、今回は口蓋外胚葉への分化も同時に起こさせるため、約3倍の1万個のES細胞から培養を開始した。
その結果、本来、視床下部組織に分化するはずだった細胞の一部が、口蓋外胚葉へと分化したのである。この現象は、大きな凝集体を形成することで分泌タンパク質「BMP」を介した細胞間のシグナル伝達が強化されるためであることが判明した。
この立体培養では、口蓋外胚葉細胞と視床下部細胞の2種類の細胞は混ざり合うことはなく、別々の層を作ることも確認されている。培養開始6日後には、お互いに隣接する配置(口蓋外胚葉が表面の層を視床下部組織が内部の層を形成)を自然と構築した(画像3)。これは、胚の中でラトケ嚢が発生する環境と良く似た状態を試験管内で再現したことになる。

|
|
画像3。SFEBq法によるES細胞からラトケ嚢の自己組織化。マウスES細胞をバラバラにし、1万個ずつを再凝集させ、視床下部と口腔外胚葉が分化しやすい培養液で浮遊させて培養する。生じた視床下部と口腔外胚葉は局所で相互作用を始め、さらに増殖因子「ヘッジホッグ」を加えると、口腔外胚葉の一部が自然とラトケ嚢(下垂体原基)を生じる |
成果の2つ目は、「ES細胞由来の下垂体前駆細胞からラトケ嚢が自己組織化」。ES細胞の立体培養で、口蓋外胚葉細胞の層と視床下部細胞の層を共存させると、実際にその間で相互作用が起こり、口蓋外胚葉細胞層の一部が下垂体前駆細胞に分化することが判明。これらの前駆細胞は、まず細胞塊の表面で数個のパッチ状の領域を作り、培養開始7日後には、下垂体前駆細胞に特有なマーカータンパク質「Lim3」が発現した。なお、マーカータンパク質とは、細胞の分化状態や分裂能などの性質を解析するために指標や目印(マーカー)となる遺伝子で、そのRNA産物や細胞内あるいは細胞表面のタンパク質などのことをいう。
Lim3陽性の領域は、分厚い細胞シート構造を作り、細胞塊の表面から内部に陥入し、次いで袋状の構造を形成した。この過程は、ラトケ嚢が発生する過程と似ている。ES細胞から自発的に形成した袋状の構造をラトケ嚢のマーカータンパク質で詳細に解析した結果、ラトケ嚢特有の性質(Lim3陽性など)を示すことが判明した。
この結果、ES細胞の立体培養を用いて、1万個の細胞からなる塊を適切な培養液で培養することで、下垂体発生に必要な口蓋外胚葉細胞の層と視床下部細胞の層が自然と形成され、それらの相互作用によりラトケ嚢が自己組織化されることが明らかとなった(画像3)
成果の3つ目は、「ES細胞由来のラトケ嚢は下垂体の内分泌細胞を生み出す」ことだ。研究グループが次に検討したのが、ES細胞由来のラトケ嚢がさらに発生を続けて、成熟した下垂体を形成するかどうかという点。
「副腎皮質刺激ホルモン」(ACTH)産生細胞は、下垂体の主要な内分泌細胞だが、過去に行われた研究の知見からタンパク質「Notch」がその分化を阻害していることが確認されていた。今回、そのNotchの作用を阻害する薬剤で処理したところ、ES細胞由来のラトケ嚢からACTH産生細胞が高頻度に分化した(非神経性細胞の中で約35~40%、全体の細胞の約4~5%)。
同様に成長ホルモン産生細胞は、「Wntシグナル」、「糖質コルチコイド」とインスリンが存在すると分化しやすいことが知られていたが、実際にこれらの促進物質の存在下では、ES細胞由来のラトケ嚢から成長ホルモン産生細胞の分化も誘導に成功している(非神経性細胞の中で約6%、全体の細胞の約1%)。
また、他の下垂体ホルモン(乳汁分泌ホルモン、性腺刺激ホルモン、甲状腺刺激ホルモン)も少ないながら分化が確認できた(画像4)。この実験から、ES細胞由来のラトケ嚢は下垂体の内分泌細胞を生み出す能力を持つことがわかり、人工下垂体として機能することを立証できたのである。

|
|
画像4。立体培養による下垂体ホルモン産生細胞の分化。ES細胞からSFEBq法で自己組織化されたラトケ嚢は、Notch阻害剤の存在下にさらに培養すると、効率よく副腎皮質刺激ホルモン産生細胞を生み出す。他の培養条件では、成長ホルモン、乳汁分泌ホルモン、性腺刺激ホルモン、甲状腺刺激ホルモンなどを産生する細胞の分化も確認されている |
4つ目の成果は、「ES細胞由来の人工下垂体は、副腎皮質刺激ホルモンを放出する」こと。続いて検討されたのが、この人工下垂体が生体内と同様の制御を受けて、下垂体ホルモンを分泌するかどうかを試験管内の実験だ。
下垂体は、視床下部から局所でのみ働く「放出ホルモン」の作用を受け、その種類に合わせて異なる下垂体ホルモンを分泌する仕組みを持つ。例えば、視床下部から下垂体へ分泌される「副腎皮質刺激ホルモン放出ホルモン」(CRH)は、下垂体からのACTHの分泌を促します。人工下垂体の場合も、生体と同様に、CRHを作用させるとACTHを大量に分泌することが確認された(画像5)。
ホルモンは微量で大きな作用を体にもたらすため、「作りすぎないように」する必要がある。生体でのホルモンの量は、フィードバック機構によって巧妙に調節され、作りすぎを避けている仕組みだ。例えば生体内ではACTHは副腎皮質に働き、副腎皮質ホルモンを産生させるが、副腎皮質ホルモンが多く作られると、それが下垂体に働き、ACTHの分泌量を減少させるという具合である。人工下垂体の場合も、生体と同様に、副腎皮質ホルモンで処理すると、CRHに反応して分泌するACTH量が大きく減ることがわかった。
要は、ES細胞由来の人工下垂体は、生体の下垂体と同様に視床下部の刺激や下流標的組織からのフィードバック制御に反応して、下垂体ホルモンの分泌を制御する能力があることを示したのである。
5つ目の成果は、「ES細胞由来の人工下垂体による下垂体機能不全モデルマウスの移植治療」。研究グループでは、人工下垂体が生体内で機能するかを確かめるため、下垂体を手術的に除去したマウス(下垂体機能不全モデルマウス)に人工下垂体を移植。移植場所は、除去手術でダメージを受けているため、人工下垂体を血流の豊富な腎臓の被膜下とした。
移植1週間後には、移植したマウスは、移植しないマウス(対照群)に比べ有為に血中のACTHや副腎皮質ホルモンの濃度が上昇。さらに、CRHを注射すると対照群では変化はなかったが、移植したマウスでは、血中のACTHの濃度が大きく上昇し、下垂体除去をしていないマウスの正常値近くまで回復した。それに伴う、血中の副腎皮質ホルモン濃度の上昇も確認されている。
また、下垂体機能不全モデルマウスの生存期間だが、自発的な活動性(自発運動量)が低下し、数週間以内にすべて死亡してしまった。一方、移植したマウスでは活動性(運動量)の回復が認められたほか、移植後8週間でも85%のマウスが生存(画像6)。このことから、人工下垂体は生体内でも内分泌器官として機能し、その移植により下垂体機能不全モデルマウスの再生治療が可能であることが実証できたというわけである。
なお、研究グループでは今回の成果により、現時点では根治療法の存在しない下垂体(神経性下垂体を除く)の主要な内分泌細胞のすべてが機能不全になる「汎下垂体機能低下症」の治療法につながるとしている。
また、今後は、ACTH産生細胞以外の下垂体ホルモン産生細胞の分化効率が低いため、それを上げていくとし、またACTH産生細胞と成長ホルモン産生細胞を含む機能性の高い人工下垂体をヒト由来のES細胞やiPS細胞から産生するために、集中的な研究開発を計画しているとした。さらに、人工下垂体の移植技術の改良を進め、より安全な皮下移植、さらには本来下垂体が存在する頭蓋骨の底部の小さなくぼみの「トルコ鞍」への移植技術を、ブタなどの中型動物を用いた研究で進めていくとしている。