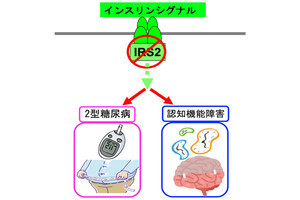
九州大学(九大)は7月12日、脳内にアミロイドβ(Aβ)の沈着がある軽度のアルツハイマー病患者において、糖尿病が脳内のインスリン抵抗性とDNAの酸化損傷を引き起こすことで、アルツハイマー病の病態を悪化させることを明らかにしたと発表した。
同成果は、九大 生体防御医学研究所 脳機能制御学分野の中別府雄作主幹教授らの研究チームによるもの。詳細は、英国解剖学会誌「Aging Cell」に掲載された。
これまでの多くの研究から、糖尿病がアルツハイマー病発症の主要な危険因子となることが指摘されてきたが、アルツハイマー病のトランスジェニックマウスモデルを用いた研究では、これを支持する結果と否定する結果の両方が報告されており、そのメカニズムは不明とされていた。
そこで研究チームは、トランスジーン(遺伝子導入)に由来する潜在的なアーティファクト(人為的構造)を克服するために、AppNL-F/NL-Fノックインマウスモデルを用いた研究を実施。具体的には、このAppNL-F/NL-Fノックインマウスは、アミロイド前駆タンパク質(APP)が過剰に産生されることはなく、生後半年から大脳や海馬にアミロイドβプラークが沈着し、生後1年半で非常に軽度の認知障害を示すアルツハイマー病の初期モデルだという。
APPは、多くの組織で発現している膜タンパク質で、神経細胞のシナプスに濃縮されており、その詳細な機能はわかっていないが、シナプスの形成、神経可塑性、抗菌活性、鉄の排出の調節などに関わるとされている。
このAPPの一部が切断されて生成されるのが、40個前後のアミノ酸残基からなるアミロイドβペプチド(Aβ40やAβ42)で、アルツハイマー病の病理学的特徴の1つである脳細胞の老人斑の主要構成成分として知られている。またAβプラークは、Aβが凝集して最終的に不溶性の塊となったもので(Aβは凝集しない段階では可溶性)、老人斑の主要構成成分であるAβ42も、Aβプラークである。
野生型とAppNL-F/NL-Fマウスに対し、生後半年から通常食または高脂肪食(HFD)で年間の飼育を行ったところ、HFDで飼育された野生型とAppNL-F/NL-Fマウスはともに同程度の肥満となり、2型糖尿病を発症したものの、AppNL-F/NL-Fマウスのみが顕著な認知機能障害を示したほか、海馬のインスリン抵抗性に加えて、Aβの沈着や本来は中枢神経におけるマクロファージとして免疫を担当しているミクログリア(グリア細胞の一種)が、自己免疫疾患的に細胞障害性を持ってしまった状態「ミクログリオーシス」の増悪が認められたという。
また、HFDで飼育されたAppNL-F/NL-Fマウス(HFD-AppNL-F/NL-Fマウス)の海馬では、海馬歯状回の顆粒細胞層が萎縮し、顆粒細胞の核にグアニン塩基の酸化で生じた8-オキソグアニンの蓄積が顕著に増加していたことも確認されたという。
さらにHFD-AppNL-F/NL-Fマウスでは、Aβ結合タンパク質の1つである「トランスサイレチン」(TTR)の発現が顕著に減少していることも確認された。TTRの枯渇が、HFD-AppNL-F/NL-Fマウスの海馬におけるAβ沈着の増加の原因であることが示唆されるという。
なお、今回の研究成果を踏まえ、研究チームでは、糖尿病患者が全員、アルツハイマー病を発症する危険性があるということではないと説明しており、軽度のアルツハイマー病の状態、つまりAβの脳内沈着がある人が糖尿病を発症することで、アルツハイマー病型認知症の発症と進展が早まる可能性があるとの見方を示すほか、糖尿病を予防することでアルツハイマー病の発症や進展をコントロールできることも示されたことから、新たな予防と治療法の開発につながることが期待されるともしている。