京都大学(京大)は2月17日、脳の視床下部に存在する20塩基程度の「マイクロRNA-33(miRNA-33)」が適応熱産生に重要であることを見出したと発表した。
同成果は、京大大学院 医学研究科の堀江貴裕助教、同・尾野亘准教授らの研究チームによるもの。詳細は、英オンライン科学誌「Nature Communications」に掲載された。
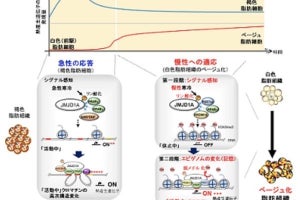
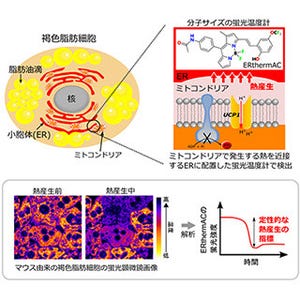
脂肪細胞には、皮下脂肪や内臓脂肪などの白色脂肪細胞と、主に、首、肩、鎖骨や肩甲骨、腎臓周辺に存在する褐色脂肪細胞の2種類がある。この2つの脂肪細胞は、同じ脂肪細胞と名はつくが、それぞれ役割が異なる。白色脂肪細胞は細胞内に栄養を脂肪として蓄えるのが仕事だ。そして褐色脂肪細胞は脂肪を分解し、熱を産生することで体温を維持することで体温の調節を担う。特に寒い環境下では、交感神経の活動が高まるにつれて褐色脂肪細胞が活性化し、体温が下がりすぎないよう熱を生み出す(適応熱産生)ことが知られている。
これまで研究チームは、コレステロールの合成および取り込みに重要な遺伝子「SREBP-2」のイントロン16にあるマイクロRNAの一種であるmiR-33の機能の研究を行ってきた。
マイクロRNAとは、22塩基前後で構成される微小なRNAで、タンパク質に翻訳されない(タンパク質の生産に関わらない)ノンコーディングRNAの一種。ただし、標的遺伝子のメッセンジャーRNAの翻訳に抑制的に作用するなど、遺伝子発現を調節する役割を担う重要な存在であることがわかってきている。実際、miR-33も20塩基程度の微小なRNAだが、この存在が低HDL-C、動脈硬化症、動脈瘤、(心臓)線維化などに関わることを研究チームがこれまでの研究で報告している。
ただし、まだ解明できていない点もある。miR-33を欠損させたマウスは肥満を生じることが確認されていたが、なぜ肥満が生じるのか、その原因は明らかとなっていなかったのである。
そうした背景を受けて研究チームが始めた今回の研究では、miR-33欠損マウスが低温環境において体温を維持できないことがまず発見された。その原因を調べると、褐色脂肪細胞からの熱産生が起きにくいことが明らかとなったのである。
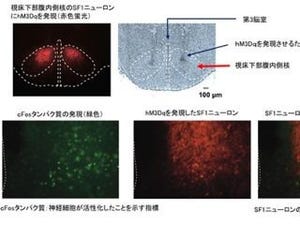
また研究チームは、交感神経の「カテコラミン産生細胞」で特異的にmiR-33を欠損させたマウスを作成。その解析の結果、このマウスが全身のmiR-33欠損マウスと同様の表現型を示すことが確かめられた。このことから、カテコラミン産生細胞こそが、miR-33欠損マウスにおける褐色脂肪細胞の機能が低下した原因と考えられたのである。
続いて、カテコラミン産細胞に特異的な、miR-33の標的遺伝子であるGABAA受容体のサブタイプ(Gabrb2とGabra4)を欠損させる(ノックダウン)実験を実施。その結果、miR-33が欠損しているとGabrb2とGabra4の発現が増加することが判明。それにより、抑制性の「GABA神経シグナル」が増強して交感神経活性を抑制されることが、褐色脂肪細胞の機能低下のメカニズムであると証明されたのである。
なおmiR-33は、寒冷刺激によって視床下部において増加することがわかっている。つまり、miR-33は視床下部において、交感神経活性の程度を増強させるスイッチとして働き、熱産生を増加させていると考えられるとしている。同様の機序は高脂肪食負荷でも起こり、熱産生を介して全身の代謝を調節していることが推察されるという。
今回の研究成果により、褐色脂肪細胞の持つ熱産生機能の生理学的メカニズムのひとつが解明されたこととなる。研究チームは、中枢神経系でのmiR-33の量をコントロールすることで、メタボリックシンドロームをはじめとした、さまざまな生活習慣病の予防と地利尿につながることが期待されるとコメントしている。