理化学研究所(理研)と東京大学(東大)、日本医療研究開発機構は2月23日、白質消失病発症の原因タンパク質「eIF2B」の立体構造を結晶構造解析により解明したと発表した。
同成果は、理研 横山構造生物学研究室 横山茂之 上席研究員と、理研ライフサイエンス技術基盤研究センター 翻訳因子構造解析研究ユニット 伊藤拓宏 ユニットリーダー、柏木一宏 特別研究員らの研究グループによるもので、2月22日付けの英科学誌「Nature」オンライン版に掲載された。
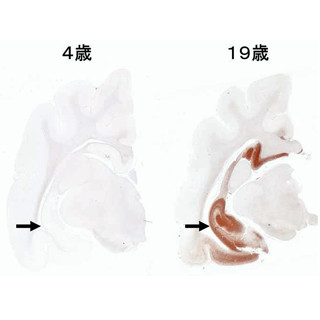
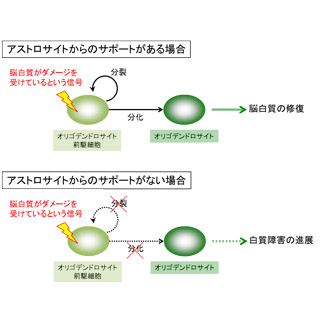
白質消失病は、幼児期に発症し、ウイルス感染や頭部外傷などのストレスを契機に急速に悪化し、大脳の白質が消失して運動機能の失調をきたす遺伝性の神経変性疾患で、罹患者の多くが死に至るとされている。この疾患の原因となる翻訳開始因子eIF2Bは、本来、細胞がタンパク質を合成する際にほかの翻訳開始因子eIF2を活性化するタンパク質だが、細胞がストレスを受けると、eIF2がリン酸化してeIF2Bの活性が低下し、一般的なタンパク質合成がいったん抑制される。しかし、このストレス応答機構や、白質消失病の発症との関連性は解明されておらず、現在のところ白質消失病に特化した有効な治療法は見つかっていない。
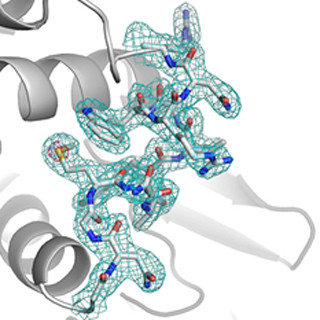
今回研究グループは、大型放射光施設「SPring-8」を用いたX線結晶構造解析で、10個のサブユニットから構成される巨大なeIF2Bの3次元構造を解明。その結果、eIF2Bの変異の大半は、eIF2に働く領域(活性部位)や、サブユニット間の相互作用面に集中していることがわかった。これは、変異によって活性部位や全体構造が損なわれ、eIF2Bの機能が低下することが、白質消失病の発症原因であることを意味している。ストレスを受けて一般的なタンパク質合成が抑制された後、抑制が解除されてストレス状態から通常状態へと回復する際に、eIF2Bの機能が低下しているために回復に必要なタンパク質を十分に合成できず、神経細胞が変性し白質消失に至ると考えられる。
さらに、独自開発した技術を活用し、eIF2BとeIF2に非天然型アミノ酸を導入して解析したところ、eIF2Bの3次元構造の上でリン酸化されたeIF2と結合する領域は、通常のeIF2を活性化する際に結合する領域とは異なることを発見。この結合様式によりリン酸化されたeIF2は、自身の活性化を起こさないだけでなく、ほかのeIF2の活性化も妨げることが明らかになった。
同研究グループは今回の成果について、白質消失病などの病態の理解、eIF2Bを標的としたストレス応答を制御する治療法の開発へ向けて、有用な基礎的情報となると説明している。