生理学研究所(NIPS)は2月25日、滋賀医科大学との共同研究により、「エピゲノム修飾因子」である「Bre1a(ブレワンエー)」が「神経幹細胞」の増殖と分化を制御していることを発見したと発表した。
成果は、NIPSの池中一裕 教授、滋賀医科大の等誠司 教授らの共同研究チームによるもの。研究の詳細な内容は、2月19日付けで米神経科学誌「Journal of Neuroscience」に掲載された。
脳の再生医療のカギを握るものとして、現在注目されているのが「神経幹細胞」だ。脳のすべての神経細胞および「グリア細胞」(神経細胞以外の脳の細胞)の源であり、成人の脳にもあって、記憶の形成や気分の安定に重要だと考えられている。
神経幹細胞は、胎児期の脳で活発に働く。大量の神経細胞・グリア細胞を産み出すが、自分自身を維持するように増殖と分化のバランスをうまく調節する必要があることから、胎児期の内から「細胞周期」(1回の細胞分裂の過程)をどんどん伸ばしていき、成人の脳では遂に非常にゆっくりとしか分裂しないようになると考えられている。この「非常にゆっくりとしか分裂しない」という性質は、さまざまなタイプの幹細胞において、遺伝子変異のリスクを減らす(すなわち腫瘍化を防ぐ)という意義があるものと推測されているところだ。
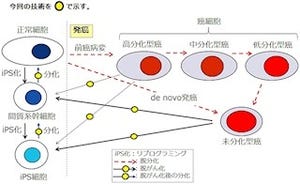
研究チームは、神経幹細胞の細胞周期と分化のバランスを取るために、両方を調節している因子があるはずだと考察し、その結果、Bre1aという遺伝子を同定した。Bre1aは、細胞の核の中でDNAが巻き付いている芯であるタンパク質「ヒストン」の1つ、「H2B」を「ユビキチン化する」(ユビキチンを付加する)ことが知られていた。その反応が引き金になり、隣のヒストンH3がメチル化され、近傍の遺伝子の発現が活性化される仕組みだ(画像1)。
近年、遺伝子の発現を調節する仕組みとして、研究者にエピゲノムの分野が注目されているが、Bre1aによるヒストンH2Bのユビキチン化もエピゲノム修飾の1つで、細胞周期や分化に関わる多くの遺伝子群の発現を制御しているものと考えられている。
Bre1aは胎児期の脳において多くの細胞で発現しているが、ごく一部の細胞では発現低下しており、これらの細胞ではヒストンH2Bのユビキチン化も低下していた。そこで研究チームは、胎児期の神経幹細胞で人為的にBre1aの発現を低下させたところ、神経幹細胞の分化が抑制されることが判明。ここには、神経幹細胞の分化抑制に重要だと考えられている、「Hes5(ヘス・ファイブ)」という別の遺伝子の活性化が働いていることも見出された。
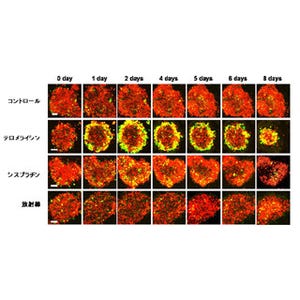
同時に、Bre1aの発現が低下した神経幹細胞では、細胞周期が伸びて、分裂がゆっくりになっていることも発見されたのである(画像2)。これらの発見により、神経幹細胞が安定して維持されるために、ヒストンH2Bのユビキチン化というエピゲノム修飾が関与していることが証明されたというわけだ。
近年、激しく増殖する腫瘍の中には、「がん幹細胞」などのようにゆっくりとしか分裂しない幹細胞のような細胞がいることが明らかになっている。ゆっくりとしか分裂しないので、分裂細胞をターゲットにした放射線療法や化学療法に抵抗性で、がんの再発に関わっているのではないかと考えられている。
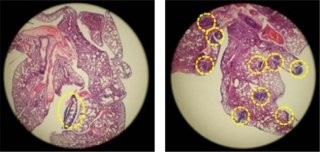
脳腫瘍の1つであるグリオーマは、神経幹細胞に近い細胞ががん化したもので、「グリオーマ幹細胞」でもBre1aがその増殖と分化を制御している可能性がある(画像3)。Bre1aを標的分子とした、脳腫瘍に対する新しい治療法の開発が期待される。