理化学研究所(理研)は2月13日、国立精神・神経医療研究センター(NCNP)との共同研究により、躁うつ病(双極性障害)の治療に用いられるリチウム(気分安定薬)のビタミン様物質「イノシトール」を介した作用メカニズムの一端を解明し、同時にイノシトールの合成経路がほ乳類の下顎の形成に関わることを発見したと発表した。
成果は、理研 脳科学総合研究センター 分子精神科学研究チームの大西哲生研究員、同・吉川武男チームリーダー、理研 バイオリソースセンター(BRC) 新規変異マウス研究開発チームの権藤洋一チームリーダー、国立精神・神経医療研究センター 精神保健研究所精神生理研究部の三島和夫部長らの共同研究チームによるもの。研究の詳細な内容は、米科学雑誌「Journal of Biological Chemistry」に掲載されるに先立ち、オンライン版に近日掲載の予定だ。
精神疾患の1つである気分障害は患者数が多く、罹患すると患者のQOL(生活の質)の低下に加え、医療コストも増加するため、社会問題化している。気分障害の中でも躁うつ病は、約1%の人が罹患する可能性のある比較的ありふれた疾患で、「うつ」状態と「躁」状態が周期的に繰り返されることから「双極性障害」ともいう。
躁うつ病の治療に使われているのが「気分安定薬」だ(画像1)。気分障害による気分の「波」を治療し、将来の再発を予防するために処方される薬剤で、リチウム製剤(日本では炭酸リチウムが使われる)に加え、バルプロ酸、カルバマゼピン、ラモトリギンといった抗てんかん薬も気分安定薬として使われている。バルプロ酸、カルバマゼピンについてもイノシトール枯渇を介して気分安定効果を発揮するとの説があるが、これらも詳細は不明だ。なお気分安定薬は、抗うつ薬だけでは治療効果が十分でない難治性のうつ病(躁うつ病とは異なり、躁状態は現れない)の患者に対しても用いられることもある。
世間一般的には、リチウムというとバッテリのイメージが強いかもしれないが、は半世紀以上にわたって使われてきた代表的な気分安定薬だ。しかし、気分安定効果がどのような仕組みによって発揮されるのか、実はわかっていなかった。ただ、「リチウムが細胞内の酵素の働きを抑制し細胞内の情報のやりとりを調節することが重要」とする仮説がいくつかある。
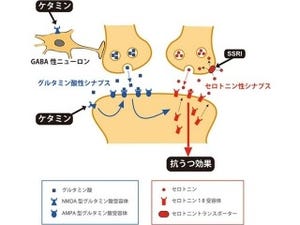
その仮説の1つが「イノシトール枯渇仮説」だ(画像2)。ビタミン様物質「イノシトール」を作り出す酵素「イノシトールモノフォスファターゼ」は、リチウムによって直接その働きが抑制される。その結果、細胞内のイノシトールの量が減少し、この学説ではこれがリチウムの薬効に重要だとしているというわけだ。ただし、最近では「GSK3(グリコーゲン合成酵素リン酸化酵素3)と呼ばれる酵素の働きを抑制することが重要」とする説も出てきており、議論になっている。
そこで共同研究チームは今回、遺伝子操作によりイノシトールモノフォスファターゼの働きだけを抑えた「細胞内イノシトール枯渇マウス」を使用し、どのような変化が現れるかの研究を行ったというわけだ。
共同研究チームは、理研BRCが保持・管理する「遺伝子変異マウスライブラリー」から2つあるイノシトールモノフォスファターゼ遺伝子の1つ「Impa1」に変異を持つ系統を探索。その結果、イノシトールモノフォスファターゼの酵素活性が検出できないほど弱くなるマウス「細胞内イノシトール枯渇マウス(T95K変異体:95番目のスレオニンというアミノ酸がリジンに変化)」が発見された。
なお理研では、「突然変異誘発剤(エチルニトロソウレア:ENU)」の投与によって、ランダムに染色体に遺伝子変異が入った(主に一塩基の置換)マウス系統が多数保持されており、そこから効率的に特定の遺伝子に変異を持つものを発見できるシステムが整えられている。システムは「RGDMS(RIKEN ENU-based gene-driven mutagenesis system)」と命名されており、研究者からの依頼による特定遺伝子変異系統の探索と分与を行う仕組みだ。
まず、成長後の細胞内イノシトール枯渇マウスの行動を観察したところ、野生型マウスと比較して動きが活発になり、「概日リズム」が延びることが発見されたのである(画像3・4)。概日リズムとはヒトを含めた動物が持つ活動に関するほぼ24時間周期のことで、ヒトは通常24時間より長いが、マウスは短い。
概日リズムが延びるのは、リチウムの投与でも起きることで、リチウムを投与した正常マウスと、細胞内イノシトール枯渇マウスの双方が、類似の行動変化を起こすことから、気分安定薬としてのリチウムの働きが、イノシトールモノフォスファターゼの働きを抑えることによるものであると推察されたというわけだ。
|
|
|
|
細胞内イノシトール枯渇マウスに見られる行動変化。細胞内イノシトール枯渇マウス(変異体)は、正常マウスと比較して活動量が高く(オープンフィールド試験、強制水泳試験)、活動周期が長くなる(輪回し活動量)など、通常のマウスにリチウムを投与したときに見られる行動変化が起きる。画像3(左)の折線グラフ縦軸:移動距離(cm/5分間)、画像4(右)の折線グラフ縦軸:輪回し回数(回/60分間) |
|
続いて、妊娠中の母マウスから出産直前(胎生18.5日)の段階で細胞内イノシトール枯渇マウスを取り出して調べたところ、下顎がほとんど形成されていないことが判明(画像5)。顎の形作りがダイナミックに起きる胎生14.5日の段階でも、下顎の形成不全をはっきり観察できることから、下顎の形成の初期段階で何らかの異常が起こっていることがわかった。
細胞内イノシトール枯渇マウスを妊娠中の母マウスにイノシトール溶液を飲ませたところ、その異常は回復した。これらのことから、顎の形成異常は、Impa1遺伝子の変異による細胞内イノシトールの減少のためだと結論付けた。この知見は顎の形成に対するイノシトールの役割を示した最初の成果だ。
通常の遺伝子破壊方法であるノックアウトの手法では、多くの場合、遺伝子を含む染色体の大きな領域が欠損していたり、外部から別の遺伝子の断片が挿入されていたりすることで、別の遺伝子の働きにも影響を与える懸念がある。一方、今回の細胞内イノシトール枯渇マウスは、1つのアミノ酸だけが変化したものなので、Impa1遺伝子の機能欠損による特異的な現象を見ていると明確に結論できる。
リチウムの気分安定薬としての薬効はさまざまな検証結果に基づく確かなもので、実際に多くの患者を救ってきた。しかし、薬の有効性が発揮される量と中毒を起こしてしまう量が近接しているため、血中濃度の頻繁な測定が必要だ。有効な濃度範囲を保っていても、口の渇き、手の震えといった副作用が現れてしまう。これはリチウムが多様な作用を持つ薬剤であることを示している。これに対し、イノシトールモノフォスファターゼの働き「だけ」を抑えることが可能な薬剤を開発することができれば、副作用の問題を回避できる可能性があるという。
今回の研究で使用した細胞内イノシトール枯渇マウスは、イノシトール枯渇がどのようにして気分の安定につながるのかを分子レベル、神経のネットワークのレベルで理解するのに役立つとする。こうした研究を進め、画期的な治療薬の標的の発見、気分障害そのものの成り立ちの解明につなげていくとした。
その場合に、同じイノシトール枯渇で起きる顎の形態形成異常の原因を分子レベルで理解することが両者に共通する分子メカニズム解明に迫る手段になると考えているとする。一連の研究がさらに加速し、効果的な治療薬の開発につながるようにするため、使用したマウスは理研バイオリソースセンターから近日提供を開始する予定とした。