岡山大学は1月16日、悪性脳腫瘍が脳内に拡がるメカニズムを特定したと発表した。
同成果は、同大大学院医歯薬学総合研究科細胞生理学分野の松井秀樹教授、道上宏之助教、藤村篤史研究員、熊本大学大学院生命研究科分子生理学教室の富澤一仁教授、魏范研助教らによるもの。詳細は米国のがん研究専門雑誌「Neoplasia」に掲載された。
悪性脳腫瘍は他のがんに比べて、正常な組織(脳組織)に拡がる性質が強く、そのため非常に質の悪いがんとして知られている。その原因として、最も有力な説とされているのが「低酸素仮説」だ。同説は、がん細胞が増えすぎて血管が破綻し、腫瘍全体に酸素が届きにくくなり、その結果、がん細胞の周辺が通常の脳組織と比べて低酸素状態になり、これをきっかけとしてがん細胞が動き回るようになり、脳内に広く散らばるとするものだが、がん細胞が動くためには細胞の梁のような構造である「細胞骨格」がうまく制御されていなければならないものの、低酸素環境と細胞骨格の制御という2つの異なる現象をつなげる因子が何であるのかについては不明となっていた。
今回の研究は、その謎の因子の特定を目指したもので、タンパク質「Cyclin G2」が、その2つの現象をつなぐ重要な因子であることを突き止めたという。具体的には、がん細胞が低酸素にさらされると、がん細胞内で同タンパク質が急増し、細胞骨格に関連する沢山のタンパク質をがん細胞の移動に適するようにコーディネイトするという指揮官的な役割を演じることを発見したという。
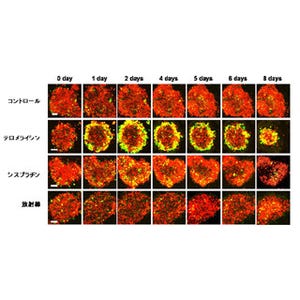
さらに、研究グループは同タンパク質がコーディネイトしている細胞骨格制御を阻害する薬剤も発見しており、実際にマウス脳内でがん細胞が拡がることを抑制できることも確認したとする。
なお、今回の成果について研究グループでは、悪性脳腫瘍の治療戦略を立てる際の新たな展望を提供するという点で、大きな成果になるとしており、効果のあった阻害剤のメカニズムの解析を進めることで、実際の患者への臨床応用が可能な薬剤の開発へとつなげ、悪性脳腫瘍の治療成績の向上をはかることが期待できるようになるとコメントしている。