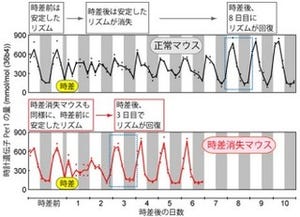
京都大学は11月8日、東京大学との共同研究により、ほ乳類において、化学修飾されたメッセンジャーRNA(mRNA)が「概日(サーカディアン)リズム」の周期を決定していたことを解明したと発表した。
成果は、京大 薬学研究科の岡村均教授、同・Jean-Michel Fustin特定研究員、同・薬学研究科の掛谷秀昭教授、東大循環器内科の眞鍋一郎講師らの共同研究チームによるもの。研究の詳細な内容は、日本時間11月8日付けで米科学誌「Cell」に掲載された。
化学修飾は物質の性質を根本的に変え、多くの生物で、これを利用して多様な生命現象が営まれている。「リン酸化」、「アセチル化」、「メチル化」、「ユビキチン化」などがその主なものだ。この内、アセチル化は、主にタンパク質の性質を変化させる重要な反応で、多くの生理機能が知られているが、核酸では用いられない。
メチル化は広く、核酸、タンパク質、特に「ヒストン」タンパク質で認められる。DNAのメチル化は、DNA中によく見られる「CpGアイランド」という配列の部分などで炭素原子に「メチル基」が付加される化学反応で、「シトシン」の「ピリミジン環」の5位炭素原子へのメチル基の付加反応だ。
DNAメチル化は、不活性化された「クロマチン」(サイレントクロマチン)を形成させる基本的には不可逆的な反応である。DNAメチル化の研究が早く進んだのは、脱アミノ化の「バイサルファイト法」など、DNA修飾されたものを検出する手法が開発されたからだが、RNAに関してはそのような方法が開発されていなかったため、長らく研究が進まなかった。
化学修飾をされたRNAがたくさんあるといわれるようになって、かれほど40年が経つ。「アデニン」の「プリン環」の6位窒素原子へのメチル基の付加反応(=mRNAのアデノシンN6位のメチル化)「RNA Methyl-6-adenosine(m6A)」が初めて報告されたのは、1974年の肝がん細胞における研究でのことだ。ところが、検出法が煩雑なことと、RNAの寿命が非常に短いことから、長い間ほとんど検索されてこなかった。2012年になってm6Aに対する抗体が開発され、それに次世代シークエンサーを組み合わせることで、m6Aが数1000もの機能遺伝子に存在すること、RNAの「3'端」近辺に多いことが報告されたのである。しかし、その生理作用はまったくわからないままだった。
岡村教授らは今回、体内時計の系でm6Aの機能を検討し、RNAのメチル化の状態で24時間という長周期が決められることを発見した。すなわち、数ある生理現象や病態の中で、時計遺伝子のフィードバックループでリズムが生まれる体内時計において、初めて「エピトランスクリプトーム」の生理的意味が明らかとなったのだ。
約24時間周期の体内時計は地球の自転に対応した、生命にとってもっとも根源的な「時間」の仕組みであり、細胞の代謝、分裂増殖、老化と密に関係し、生体を活動期と非活動期(睡眠)という劇的な変動の中での恒常性システムの維持を日夜遂行している。
そして体内時計が注目されるもう1つの理由は、それがすべて時計遺伝子の転写・翻訳を介したフィードバック機構によって生み出されることだ。リズム自身はこの転写ループで生み出されるが、なぜそれが24時間という周期なのかはわかっていなかった。
そこで岡本教授らは今回、mRNAのメチル化という反応が体内時計の周期の長さを決定していることを明らかにしたのである。この発見はメチル化阻害剤である「デアザアデノシン(DAA)」の投与実験に始まる。DAAは、細胞でも、培養下でも、マウスの行動の個体レベルでも、体内時計の周期を大幅に延長させた(画像1)。
|
|
|
|
|
メチル化阻害剤(MeI)投与にて細胞リズムの延長(Per2::luc MEF)(画像1(左))、脳室内投与にて行動リズム周期の延長(画像2(中))が惹起される。(画像3(右))ChIP-Seq解析で、3'末端近傍のRNAは大量にメチル化されており、これはDAAで強く阻害される |
||
岡村教授らは、よく知られたDNAや、ヒストンや非ヒストンタンパク質のメチル化の阻害はリズムの延長を誘導しないことから、RNAのメチル化が関与すると考察。今までまったくその生理機能が明らかでなかったmRNAのアデノシンN6位のメチル化(m6A)に注目し、この特異抗体を用いて「RNA-Seq解析」が行われた結果、時計遺伝子である「Per1」、「Per2」、「Bmal1」のmRNAが高度にm6A化されていることが判明した。
さらに、m6Aメチル化酵素である「Mettl3」の発現をノックダウンさせると、このメチル化が大きく抑制され、その結果リズムも延長することが確認されたのである。逆に、Mettl3を過剰発現させると、リズム周期は短縮。この結果は、時間生物学の分野にとっては、最近のゲノムワイドな大規模RNA-Seq解析によって提唱された「転写後レベルのRNA制御によるリズム発生仮説」にも合致し、その具体的な分子機序が初めて明らかにされた。体内時計が24時間という周期を取るのはRNAレベルの制御がカギだったのである。
画像4は、エピトランスクリプトーム解析による24時間周期形成のモデル。時計遺伝子の転写翻訳フィードバックループ「TTFL」におけるRNAメチル化を示している。時計遺伝子は転写され、pre-mRNAはスプライシングを受けmRNAとなり、核外に移行して翻訳されるという流れだ。ただしm6Aメチル化により、これらのRNAプロセスは影響を受ける。なお、RNAメチル化がPre-mRNAレベルで起こるのか、mRNAレベルでメチル化・脱メチル化反応が起こるのかは不明だ。
今回の発見は生体リズムの観点からだけでなく、RNAに関する見方を根本的に変えたものとして意味があるという。今までの考えでは、RNAはDNAの遺伝情報を忠実に運ぶ運び屋に過ぎないと考えられてきたのだ。RNAは糖(リボース)と塩基がリン酸を介して繋がった紐状のものだが、今回の研究は、RNAが転写された後、RNA塩基の1つであるアデニンの窒素に新たな化学修飾(メチル化)が負荷され、これにより新たな機能が生まれることを明らかにした研究である。
RNAの核酸塩基が、A、U、G、Cの4塩基であることはどの高校教科書にも書いてある話だが、2012年の「Cell」と「Nature」に掲載された論文によって、塩基の1つであるアデニン(A)が多くの部位でメチル化修飾を受けることが明らかになった。すなわち、m6Aは20%ものヒト遺伝子に存在し、5000個以上のmRNA分子がm6A化されていることが、2012年になってようやくわかったのだ。しかし、その機能は今までまったくわっていない。
岡村教授らは今回、時計遺伝子が転写レベルでリズムを形成する体内時計でのm6Aの機能を検討し、RNAのメチル化の状態で24時間という長周期が決められることを明らかにした。すなわち、数ある生理現象や病態の中で、時計遺伝子のフィードバック制御でリズムが生まれる体内時計において、初めてRNA修飾の生理的意味が明らかとなったというわけだ。
このm6Aの機能解明は、RNA修飾を探求するエピトランスクリプトームの生理学的な意味を初めて明らかにしたもので、この分野の開始を告げる画期的な研究ともいえるという。RNA修飾は動的に制御されており、肥満、発がんなどに関与する遺伝子にも多く見られる。岡村教授らは今後も引き続き今回の研究チームで研究を続け、エピトランスクリプトームを用いた生活習慣病の原因解明と治療法の開発に取り組んでいくとした。