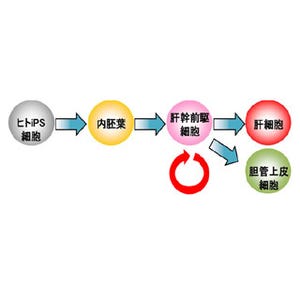
明治大学(明大)などの研究グループは10月10日、人工酵素と体細胞核移植を組み合わせた方法により、6カ月という短期間で免疫のない(免疫不全)ブタの作出に成功したと発表した。
同成果は、明大の渡邊將人 特任講師と長嶋比呂志 教授、自治医科大学の花園豊 教授らによるもの。詳細は2013年10月9日(米国東部時間)に発行された科学誌「PLoS ONE」に掲載された。
ブタは解剖学的、生理学的、血液学的にヒトへの類似性が高いため、ヒトに近い知見を得られる実験動物としてよく利用され、現在では糖尿病やアルツハイマーなどヒトの病気を再現する病態モデルブタの作出も行われているほか、ヒト-ブタ間における異種移植において、臓器ドナーとして遺伝子改変ブタを利用する研究も進められている。
特定の遺伝子機能を消失させる遺伝子ノックアウト技術は、ヒトの病気を模倣した病態モデルブタの開発に有用かつ重要となるが、従来の作製法では、受精卵より作出された未分化で増殖性の高い胚性幹細胞(ES細胞)を利用した相同組み換えを行い、この組み換えES細胞を初期胚に導入することでノックアウト個体の作出が行われている。
しかし、ES細胞はマウスにほぼ限定的であり、ES細胞が樹立されていないブタでは、体細胞を用いて相同組み換えにより遺伝子ノックアウト細胞を取得し、これを核ドナー細胞として体細胞核移植によってノックアウト個体を作出する必要があるが、体細胞では相同組み換えが非常に低頻度でしか起こらないため、実際に個体を得るまでには多くの時間を要し、この非効率性と煩雑さが遺伝子ノックアウトブタ作出の大きな障害となっていた。
そうした中、研究グループでは、これまでの研究において、ジンクフィンガーと呼ばれDNAに結合する性質を持つタンパク質のドメインと、ヌクレアーゼと呼ばれるDNAを切断するハサミの役割を果たすタンパク質のドメインから成る人工酵素「ジンクフィンガーヌクレアーゼ」による遺伝子ノックアウトがブタ初代培養細胞において可能なことを示してきた。この成果から後、いくつかの遺伝子ノックアウトブタが作出されてきたが、それらの作出には、ジンクフィンガーヌクレアーゼの発現にプラスミドDNAが利用されてきた。しかし、プラスミドDNAを用いた方法は、動物個体のゲノムに外来遺伝子が挿入される懸念があり、このことは動物が持つ本来の遺伝子を破壊してしまうリスクがあることから、今回、研究グループでは、mRNAが通常ではゲノムへ組み込まれないことを利用し、ジンクフィンガーヌクレアーゼをコードするmRNAと体細胞核移植技術と組み合わせることで、目的以外の遺伝子機能を傷つけるリスクのない安全なノックアウトブタの作出を試みたという。
特に免疫機能のない(免疫不全)動物は拒絶反応を起こさないため、同種のみならず、異種動物の細胞・組織の移植が可能であり、がん研究、ヒトiPS細胞などの幹細胞移植研究、創薬研究など、さまざまな研究に有用であることから、同手法による免疫不全ブタ(SCIDブタ)の作出に取り組んだとする。
具体的には、ヒトSCID(重症複合型免疫不全症)の多くは、インターロイキン2受容体γ鎖(IL2RG)遺伝子の変異により起こることが知られ、実際にIL2RGをノックアウトしたマウス、ラット、ブタはヒトと同様の症状が現れることが知られていることから、免疫不全ブタの作出にあたって、IL2RG遺伝子をノックアウトすることとし、DNAと異なりmRNAが通常ゲノムへ組み込まれないことを利用して、ジンクフィンガーヌクレアーゼをコードするmRNAを合成し、これを体細胞である皮膚由来線維芽細胞へ導入したという。
|
|
|
遺伝子ノックアウトに伴う外来遺伝子挿入のリスク。従来の相同組み換えによる方法(A)は、遺伝子機能をなくすためにターゲティングベクターの導入が必須。また、プラスミドDNAを用いたジンクフィンガーヌクレアーゼによる遺伝子ノックアウト方法(B)においても外来遺伝子の挿入リスクがある。今回研究で開発された新手法(C)では、外来遺伝子が挿入されることなく遺伝子ノックアウトを行うことが可能 |
これにより、一時的にジンクフィンガーヌクレアーゼを細胞内で発現させ、遺伝子挿入を起こさせずに目的の遺伝子に変異を誘導し、体細胞核移植に使用するIL2RG遺伝子の機能を消去したノックアウト細胞(核ドナー細胞)を得ることに成功。一般に、体細胞を用いた相同組み換えの頻度は非常に低いが(100万個から1億個の細胞あたり1回程度)、同手法では、1万倍以上の効率で変異を導入することが可能であることを確認したほか、通常12カ月ほど要する時間を約6カ月へと短縮し、IL2RGノックアウト個体を得ることができることも確認したという。
また、そうして作出されたIL2RGノックアウトブタは、IL2RGの発現が完全に欠損し、免疫に必須な器官として知られる胸腺を欠失していることが確認されたほか、免疫細胞であるリンパ球(T細胞、NK細胞)を欠損していることも確認されたことから、ヒトSCIDと同様の症状が現れることが判明した。
|
|
|
免疫のないブタの免疫細胞(T細胞、NK細胞)の欠損。正常なブタ(左)には免疫細胞であるT細胞の分化、成熟を行う器官である胸腺があるが(白矢頭)、免疫のないブタ(右)では欠失している。また、免疫細胞であるT細胞、NK細胞も欠損している |
ちなみに、今回作出されたSCIDブタは、通常の飼育環境では免疫不全により死んでしまうため、分娩を行わなかったが、すでに樹立されている核ドナー細胞から体細胞核移植を行うことで、同じSCIDブタの再作出が可能だという。
なお、今回開発されたノックアウトブタは、ヒトSCIDと同様の症状が確認されたことから、よりヒトの病態を忠実に再現するSCIDモデル動物として、SCID患者由来iPS細胞を用いた幹細胞移植治療法の検討などSCID患者の治療法の確立につながることが期待されると研究グループはコメントしているほか、ジンクフィンガーヌクレアーゼをコードするmRNAの利用と体細胞核移植技術を組み合わせにより、目的以外の遺伝子機能を傷つけるリスクなく、短期間で効率的に遺伝子ノックアウトブタを作出することが可能となったことは、今後さまざまな遺伝子に対するノックアウトブタ作出への利用が大きく見込まれることから、疾患モデルブタや異種移植ドナーブタなどを用い、ヒトiPS細胞の機能・安全性評価、ヒト組織・臓器の再生、がんなどのさまざまな医学研究に利用されるブタの開発が加速し、げっ歯類モデルなどの小動物だけでは得られない、よりヒトに近い知見を得られることが期待されるとしている。