生理学研究所(NIPS)は9月6日、痛み刺激を感知するセンサの1つでワサビの辛みを感知するほか、全身の皮膚の神経においては痛みセンサとして働く「ワサビ受容体」が、炎症時の痛みや神経障害後に起こる痛みに、どのように関与しているのかを明らかにしたと発表した。
同成果は、NIPS細胞生理研究部門 岡崎統合バイオサイエンスセンターの周一鳴研究員、富永真琴 教授らによるもの。詳細は「Nature Communications」に掲載された。
今回、研究グループは、マウス感覚神経のイオンチャネル「TRPA1」に対して研究を実施、その結果、普通のTRPA1タンパク質より30アミノ酸だけ小さいスプライスバリアントが存在することを発見し、普通のTRPA1を「TRPA1a」、スプライスバリアントを「TRPA1b」と命名した。
この生成メカニズムを検討した結果、TRPA1 DNAからの転写過程において「TRPA1a mRNA」と「TRPA1b mRNA」が生成され、それぞれが翻訳されて2つのTRPA1タンパク質が生成されること、ならびに細胞の中でTRPA1aとTRPA1bが結合することで、細胞膜にTRPA1a/TRPA1b複合体量が増えることが判明した。
また、このTRPA1a/TRPA1b複合体の働きの調査として、活性化メカニズムの異なる2つのTRPA1活性化剤であるてワサビの辛み成分「AITC(アリルイソチオシアネート)と「2-APB(ツーエーピービー)」を用いて活性化したTRPA1を介して流れるイオン電流の測定を行った結果、TRPA1aとTRPA1bの両方がある場合、単体よりも大きな電流が観察されることを確認(TRPA1bだけでは電流は見えないことも確認された)。
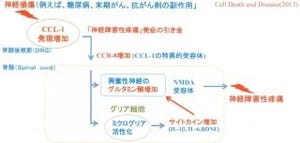
さらに、炎症性疼痛モデルマウスの感覚神経で、炎症発生後にTRPA1b遺伝子(mRNA)量が増加していくことも確認。
|
|
|
炎症性疼痛モデルにおけるTRPA1b遺伝子の発現変化。正常マウスではTRPA1b遺伝子(mRNA)は14日まで変化しないが、起炎物質「CFA」を足底に注射した炎症性疼痛モデルマウスでは、TRPA1b mRNA量がどんどん増えていくのがわかる。また、神経障害性モデルでも同様の現象が認められた |
加えて、神経障害性疼痛(神経に障害が起こった後に、神経損傷自体は治癒しても痛みが続く状態で、慢性疼痛の一種)モデルマウスでも同様にTRPA1b遺伝子(mRNA)量が増加していることが確認されており、これまでの研究から、そうした炎症性疼痛モデルマウスや神経障害性疼痛モデルマウスの感覚神経ではTRPA1の応答性が増大していることが知られていることから、TRPA1bの増加によってTRPA1活性が増大して痛み増強につながっているとの結論を得たという。
|
|
|
TRPA1bの量と疼痛増強のモデル図。炎症時や神経障害時にはTRPA1bが増え、感覚神経細胞膜上のTRPA1a/TRPA1b複合体量が増加し、TRPA1の応答性が増強して大きな電流が流れることにより痛み増強につながるということが考えられた |
今回の結果について研究グループは、TRPA1bと同一のものはヒトでは見つかっていないが、同様のことがヒトでも起こっていると想定されるため、TRPA1のスプライスバリアントやその調節因子が炎症性疼痛や神経障害性疼痛の治療のための新しい創薬ターゲットになることが期待されるとコメントするほか、病態時における選択的スプライシングの役割の解明につながることが期待されるとしている。