新エネルギー・産業技術総合開発機構(NEDO)、浜松医科大学、浜松ホトニクスの3者は、アルツハイマー病などの患者の脳における病態を解明して的確な治療につなげる、「次世代PET診断システム」(画像1~3)の確立に成功したと共同で発表した。
|
|
|
|
|
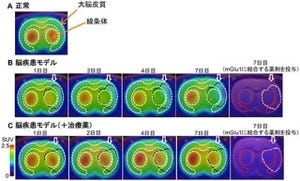
画像1(左):今回開発された頭部用PET診断装置。画像2(中):今回開発されたPET用イメージング薬剤。ニコチン受容体に働きかけ、画像3(右)のように頭部PET診断装置により測定を可能にする。画像3:装置で計測したアルツハイマー患者の脳画像(α7ニコチン受容体画像)。 |
||
近年、少子高齢化が進む中、認知症、アルツハイマー症候群、躁うつ病(小児における多動性障害)などの精神性疾患の増加が社会的に大きな問題となっており、病態の理解や早期診断が急務となっている。現時点でのこれら精神性疾患の診断法は問診が主流だが、MRI(核磁気共鳴画像法)やPET(陽電子放射断層撮影法)を用いた新しい診断法も開発が進んでいるところだ。
認知症のPET研究では、アルツハイマー病の病因とされるタンパク質「アミロイドβ」の脳への蓄積を画像化する「アミロイドイメージング」が主流である。ただしそれだけでは不十分で、認知機能の変化をより反映するイメージング薬剤が望まれてい状況だ。中でも期待されているのが、脳の神経活動を維持する上で不可欠な存在である「ニコチン受容体」を効果指標として用いた新しい診断や治療法だ。この受容体は機能異常が起きると、アルツハイマー病、パーキンソン病、統合失調症などの原因になる可能性が指摘されている。
さらに、ニコチン受容体はいくつかのサブタイプが存在し、脳内で認知症に関わるものには主に「α7」と「α4β2」の2種類だ。α7サブタイプは記憶や学習に関与しているとされ、α4β2サブタイプは注意や感情に関与しているとされる。前者は臨床利用が可能な受容体結合性の高いイメージング薬剤は未だ開発されておらず、後者は種々の化合物を用いる検討が始まっているがまだ端緒についたばかりで、国内での臨床利用報告はないのが現状だ。
また現状のPET計測では、比較的長時間にわたって被験者を固定する必要があるため、患者の苦痛が大きく、長時間の測定が困難という問題点がある。特に、中等症以上に病態が進んだ認知症患者は静止状態を保つことが困難であり、アルツハイマー型認知症の確定診断は、死後の剖検脳でアミロイドβタンパクの沈着を病理学的に証明している状況だ。
経済産業省とNEDOが中心となって全国規模でMRIやPETなどを利用してアルツハイマー病の評価基準を作成する取り組みの「J-ADNI(Japanese Alzheimer's Disease Neuroimaging Initiative)」では、アルツハイマー病をごく初期段階で描出できる画像マーカーの研究が行われており、特に近い将来における有効な認知症の根本治療薬の開発が期待されている。これらの問題に合理的に対処するために、新規ニコチン受容体イメージング薬剤を用いて、比較的自由に動いても検査可能な仕組みにして被験者の負担を軽減し、かつ高精度に計測できるPET装置の開発が望まれていたというわけだ。
今回の研究開発では、α7およびα4β2ニコチン受容体に特異的に結合するリガンド(受容体に特異的に結合する物質)を用いたイメージング薬剤の高効率な自動合成法が確立され、α7イメージング薬剤で臨床利用が可能な受容体結合性の高いものとして世界初となる「[11C]Me-QAA」が開発された(画像2)。なお11Cとは質量11の炭素のことで、一般的な陽子・中性子共に6個ずつの安定な炭素12よりも中性子が1個少ない、放射性同位体だ。
また、α4β2イメージング薬剤としては、「[18F]2FA」および「[11C]5MA」を国内で初めて臨床利用のための実用化開発がなされた形だ(18Fは質量18のフッ素のことで、安定同位体の質量19のフッ素より中性子が1個少なく、陽子・中性子共に9個ずつの放射性同位体)。同薬剤の特異性と安定性については、実験動物を用いた前臨床PET評価と、臨床利用によるPET評価が終了しており、それぞれ目標の放射化学純度と放射化学収量が達成されている。
そして頭部用PET検出器ヘッドは、新しいレーザー加工技術を用いた高精細シンチレータと高安定な光半導体素子「MPPC(Multi Pixel Photon Counter)」を用いて小型・軽量を実現し、高解像力で高感度なものが開発された。従来の頭部用PET検出器ヘッドに比べ、約4分の1と小型化(体軸方向の視野が202mm、断層面内の視野が直径330mm)し、質量200kgと約5分の1の軽量化を達成したのである。
また、レーザー加工で作成した1.2mmピッチのシンチレータにより、高分解能化が図られると同時に、「4層独立読出しDOI(Depth-of-Interaction)検出器」により視野周辺まで解像力劣化の少ない均一な分解能が得られる高性能PET装置となった。装置の特性としては、従来の頭部用PETと比べて解像力が向上しており、視野中心付近の分解能は2.0mm以下、視野中心から120mm離れた位置において2.5mm以下の空間分解能で、同時計数時間分解能は3.0ナノ秒以下となっている。
小型・軽量な検出器ヘッドが実現したことで、被験者の頭部を固定せずに頭部の動きを検知し、その情報を基にPET計測で収集したデータを補正する技術と、被験者の視野外移動を避けるために検出器ヘッド部の追従機能が開発された。体動補正には、頭部にLEDマーカーを取り付け、浜松ホトニクスが開発した2台の「高速インテリジェントビジョンシステム(IVS)カメラ」(生体の網膜が持つ優れた画像処理機構の一部をハードウェアで実現した視覚センサ)が用いられている。IVSカメラによって計測された3次元体動データから3次元位置情報と回転情報が計算され、PET検出器からの収集データを位置補正して、画像再構成位置補正誤差6mm以下とぶれのない良好な画像が得られる仕組みだ。
また、被験者頭部が視野から外れたり、被験者が検出器ヘッド部に衝突したりするのを防ぐために、PET検出器ヘッド部を被験者の動きに合わせて移動する機構も取り付けられている。体動追従性能としては、3秒以内に検出器リングを追従移動させ視野内に戻すことが可能だ。具体的には、被験者を5分間計測したデータを各種補正および体動補正が行われた後に、再構成した3次元画像を5分以内で取得するため、臨床での実用上も充分な性能となっている(画像4)。
今回の研究開発において、新規ニコチン受容体イメージング薬剤の臨床評価が行われ、新規頭部用PET装置の性能評価および臨床応用への適応試験を実施して有用性が検証され、高齢者認知症の早期診断・治療効果判定システムとしての有効性が評価されて「次世代PET診断システム」の確立となった。
また、α4β2ニコチン受容体イメージング薬剤[18F]2FAに関しては、以下の臨床研究が実施されている。まず既存PET装置を利用した研究では、アルツハイマー病におけるアミロイド沈着と「ミクログリア」活性の関係が明らかにされた。また、正常加齢におけるアミロイド蓄積が脳機能に悪影響を及ぼすことも明らかにしている。そして、アルツハイマー病患者にて[18F]2FAの受容体結合能の変化が明らかにされた。
次に、次世代PETシステムを用いて、[18F]2FAを投与したボランティアを非拘束で計測し、従来型PET画像と同等以上の画質が得られたことも確認されたのである(画像5)。最後に、先行するJ-ADNI研究で利用される「「[11C]PIB」」によるアミロイドβタンパクイメージングデータと、[18F]2FAによるニコチン受容体イメージングデータとの関連、および「神経心理データ」(認知機能、記憶、実行機能などの知的機能について、口頭での質問や、文字や図形、絵などの書き取りにより検査した結果)との関連が確認された。さらに今回の研究開発終了後、α7ニコチン受容体イメージング薬剤[11C]Me-QAAを用いて、非拘束の頭部用PET装置で認知症患者を撮影した画像の取得にも成功している(画像6)。
|
|
|
|
画像5(左):α4β2ニコチン受容体イメージング薬剤[18F]2FAを用いて、頭部用PET装置で正常者および認知症患者を撮影した画像。画像6(右):α7ニコチン受容体イメージング薬剤[11C]Me-QAAを用いて、非拘束の頭部用PET装置で認知症患者を撮影した画像 |
|
今回開発されたPET装置について、浜松ホトニクスは製品化を予定しており、検出器の医療機器メーカーへの供給を見込んでいる。また同社では、α7ニコチン受容体のPETイメージング薬剤について、より半減期の長い18Fで標識した「[18F]」Me-QAAを開発した後、医薬品会社にライセンスアウトし、7~10年後の製品化を見込んでいるとした。
さらに将来的な発展としては、今回のイメージング薬剤を、認知症治療薬の候補化合物との脳内相互作用を非侵襲的に評価できる「創薬支援ツールとしてのPETプローブ」として用いることも可能だとしている。これが実現すれば、有効な治療薬の開発スピードが一層速まり、高齢者認知症の治療に大きく貢献することが期待されるとした。