東北大学は6月3日、遺伝子組換え技術を用いて、マウスを対象にして慢性腎臓病で併発する腎性貧血のモデル動物の開発に成功し、赤血球を作るのに不可欠なホルモンである「エリスロポエチン(EPO)」の採用機序の一端を解明したと発表した。
成果は、東北大 大学院 医学系研究科の山本雅之教授(東北メディカル・メガバンク機構 機構長兼任)、同・山㟢瞬研究員、同・鈴木教郎講師らの研究チームによるもの。研究の詳細な内容は、現地時間6月3日付けで英国科学誌「Nature Communications」に掲載された。
腎臓は、体内の老廃物を尿として排出する重要な役割を担っているほか、EPOを分泌する臓器として重要である。そのため、慢性腎臓病が進行するとEPOを十分に作ることができなくなり、重篤な貧血「腎性貧血」を来す。
慢性腎臓病は糖尿病や高血圧といった生活習慣病によって引き起こされ、その患者数は国内だけで1330万人と考えられており、成人の8人に1人が抱える国民病だ。しかし、モデル動物などの研究材料が不足しており、病態が解明されていないことから、効果的な治療法が開発されていないというのが現状の大きな課題だ。
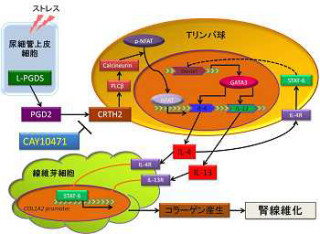
またEPOは、出生前は肝臓から分泌されるが、出生後は主に腎臓から分泌され、骨髄での赤血球形成を促進する(画像1)。赤血球は酸素を運搬する役割を担うため、生体に供給される酸素の量が不足すると、人体はEPOの分泌量を増大させる仕組みを持つ。これまでに、腎臓でEPOが作られるメカニズムは明らかにされておらず、腎性貧血の病態は解明されていなかった。
研究チームは今回、遺伝子組換え技術を用いて、腎臓でEPOを作ることのできないマウスを作成することに成功。これまで知られている遺伝子改変マウスの内、重篤な貧血を発症するものは出生できなかったが、今回のモデルマウスでは、肝臓からのEPO分泌量を維持させたため、十分な赤血球量を持って生まれてくることができたというわけだ。
そして出生後に主要なEPO分泌臓器が腎臓に切り替わると、徐々に赤血球が減り、赤血球数が正常のマウスの4割ほどに低下し、重篤な貧血を発症。その結果、貧血による心臓の負担が増えるため、心肥大が観察された。しかし、寿命や繁殖能力に大きな変化は認められていない。
続いて研究チームは、この腎性貧血モデルマウスにEPO製剤を投与。すると赤血球数が増え、貧血が改善されるのが確認された。このマウスの骨髄には赤血球の前の段階の細胞が蓄積しており、それらの細胞にEPOが作用して赤血球が作られることが明らかになったのである。
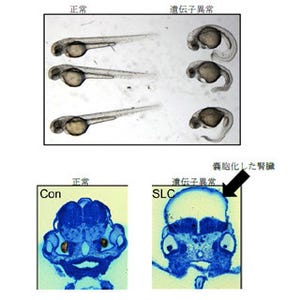
さらにこのマウスを利用して、腎臓の中でEPOを作る細胞の観察が行われた。その結果、腎臓に多数存在する「線維芽細胞」の多くがEPOを作る能力を備えているものの、ごく一部の細胞だけが実際にEPOを作っていることが判明したのである(画像2)。
|
|
|
|
EPOを作る細胞の腎臓内での分布。通常、腎臓でEPOをつくっている細胞(赤)は非常に少ない(画像2(左))。今回作出されたモデルマウスの腎臓を解析したところ、皮質と「髄質外層」という領域において、多くの細胞がEPOを作る能力を有していることがわかった(画像3) |
|
今回の腎性貧血モデルマウスによって、腎性貧血の病態解明が進み、今後、新規に開発された貧血治療薬の投与法や効果を検討する動物モデルとしても有用な材料となり、効果的な治療法の開発に繋がることが期待されるという。また、貧血と合併症との関連について理解を深めることが可能となるとしている。