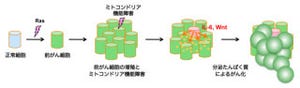
神戸大学は月30日、大腸がんや膵臓がんをはじめとする多くのがん発症に関わり、がんの約20%の原因となっている「rasがん遺伝子」が作り出すタンパク質(Ras)の働きを止める抗がん剤開発候補物質の同定に成功したことを発表した。
同成果は同大学大学院医学研究科の片岡徹 教授、島扶美 准教授、高輝度光科学研究所および理化学研究所(SPring-8)所属の熊坂崇氏らによるもの。詳細は4月29日の週に「米国科学アカデミー紀要(Proceedings of the National Academy of Sciences of the United States of America:PNAS)」に掲載される。
近年、がん遺伝子が作り出すたんぱく質の機能を特異的に阻害することで、がん細胞の増殖を抑制するがん治療薬(分子標的薬)が複数開発され、イマチニブ(慢性骨髄性白血病)などに対して臨床現場で治療効果を上げることが確認されるようになってきた。しかし、その適用範囲はイマチニブなど、限られたものとなっており、広い範囲のがんの治療に有効なものはまだない。
一方、Rasは大腸がんで40~50%、膵臓がんでは60~90%ほどの割合で、遺伝子の突然変異による活性化が認められていることから、がん治療薬開発の有望な分子標的として考えられており、すでにその機能阻害剤として、Rasの翻訳後脂質修飾の1つであるファルネシル化(Rasが形質膜に移行し機能を発揮するのに必須)を阻害する薬剤 (ファルネシル転移酵素阻害剤)の研究開発が行われてきたが、患者の延命効果が認められないことから開発が頓挫した状況となっている。
そのため、これまでRasを分子標的としたがん治療薬は、臨床の現場で使用可能なものが存在しない状況であり、がんの治療薬として切望されているものの、その実現には、Rasたんぱく質の分子表面上に、薬剤が結合・作用する良好なポケット構造がないことから、ほぼ不可能と考えられてきた。
今回、研究グループは、Rasの分子表面上にポケット構造を発見し、そのポケット構造情報に基づき、コンピュータシミュレーションならびに試験管および細胞レベルでの活性検定を組み合わせた独自手法により、ポケットに特異的に結合することで、Rasとその標的たんぱく質(Rafたんぱく質など)との結合を阻害し、Rasが引き起こす細胞がん化シグナルの伝達を遮断する3種類の物質(低分子化合物)を発見したという。
「Kobeファミリー化合物」と命名されたこれらの物質は、共通の基本構造を持ち、マウスに移植したヒト大腸がん細胞の腫瘍形成を抑制する顕著な抗がん作用を示したという。
Kobeファミリー化合物は共通の母核(基本)構造を有するものの、特許調査上はがん治療薬としての登録はなかったことから、同大では、これらの物質を新規がん治療薬開発候補(Ras阻害物質のスクリーニング方法も含め)として、国内特許出願を実施したほか、近々米国での出願も行う予定としている。
なお、今回、発表された3種類の化合物は、臨床試験に供するには、毒性および活性の点でまだ十分ではないため、研究グループでは現在、化学合成メーカーとの共同研究のもと、構造展開(化合物の構造改良)を進めているとしている。また、医薬品開発には一般的に長い時間が必要とされることから、今回のRas機能阻害物質が即座に臨床使用となることは難しいが、研究成果の一部を公開することで、Ras機能阻害剤の研究開発を行っている世界中の企業ならびに研究機関での研究開発を加速させ、開発競争を通じて、真に臨床の現場で役立つ医薬品が一日でも早く患者に届けたいと思っているともコメント。さらに大学としても、学内外の協力のもと、可能であれば開発品の臨床評価もインハウスで行えるような研究内容に育てて行きたいとしている。