理化学研究所(理研)は4月23日、東北大学、名古屋大学(名大)、東京電機大学(電大)との共同研究により、生体膜に存在する受容体の1つ「TRPチャネル(Transient receptor potential)」が、1種類でさまざまな刺激に柔軟に応答できる仕組みの一端を解明したと発表した。
成果は、理研 放射光科学総合研究センター 分子シグナリング研究チームの山下敦子チームリーダー(現・岡山大学大学院 医歯薬学総合研究科 教授)、同・伊原誠研究員(現・近畿大学 農学部講師)と、東北大大学院 工学研究科の魚住信之教授、浜本晋助教、名大 構造生物学センターの甲斐荘正恒教授、同・宮ノ入洋平特任助教、同・武田光広特任助教、電大の矢部勇研究員らの共同研究チームによるもの。研究の詳細な内容は、近日中に米国科学雑誌「Journal of Biological Chemistry」オンライン版に、印刷版6月14日号に掲載される予定だ。
細胞やその細胞内にある細胞小器官の膜(生体膜)には、外界からの刺激を受け取り、それを情報に変換する「受容体」と呼ばれるタンパク質が存在する。受容体はいわばセンサやインタフェースといった存在であり、何らかの刺激を受け取ると、それをきっかけに細胞同士や細胞内外の情報伝達が行われ、特定の生理現象を発生させるなど、生体の生命活動の維持に重要な役割を持つ。
受容体の1つとして、生体膜に存在する「膜貫通タンパク質」(膜に突き刺さって貫通しているタンパク質)のイオンチャネル型受容体がある。イオンチャネル型受容体はイオンを通過させるポアと呼ばれる構造があり、ゲートと呼ばれる部分の開閉によってカルシウムイオンなどを透過させることでイオンの流れを制御して、膜内外における電位やイオン濃度の変化を引き起こし、迅速な情報伝達を行う。そのイオンチャネル型受容体の1種がTRPチャネルというわけだ。
TRPチャネルは温度や化学物質、浸透圧などのさまざまな刺激に応答することが知られている。ヒトやげっ歯類、鳥類、ショウジョウバエ、線虫、ゼブラフィッシュなどにおいて視覚、味覚、嗅覚、聴覚、触覚、温覚、そのほかさまざまな物理・化学刺激の受容に重要な存在となっている。
ヒトが備えているTRPチャネルは27種類あり、これらはよく似た構造と機能を持つイオンの透過領域と、各種類に応じて多様な構造や機能を持つ細胞内領域からなると推測されている。外部からの刺激を感知するセンサタンパク質としての機能や、前述したように視覚や味覚などの感覚受容のシグナル伝達など、生命活動の中でも重要な機能に関わっているという。また、TRPチャネルの一部が痛みの受容にも関わることから、TRPチャネルを標的とした鎮痛薬開発も進行中である。
このようにTRPチャネルについてはさまざまなことがわかっているが、実は不明な点も同様に多い。例えば、TRPチャネルの1種であるカプサイシン受容体「TRPV1」は、化学物質による刺激や温度・浸透圧の刺激に応答するなど、TRPチャネルは一般的に複数の異なる刺激に応答する機能を持っているが、そのメカニズムがわかっていないのである。
これまでの研究から、電子顕微鏡を使った低い分解能でのTRPチャネル全体像は解析されているが、全体の高い分解能での立体構造が解明されていないだけでなく、チャネルの開閉制御に関わる領域の立体構造もごくわずかな例しか報告されていない。そうした背景を受けて、研究チームはTRPチャネルの特徴的な機能を生み出す立体構造の詳細な解明に挑んだのである。
研究チームはまず、酵母や真菌類が比較的単純な構造のTRPチャネルを持つことに着目。さまざまな酵母・真菌類のTRPチャネルを調査したところ、小麦などに赤カビ病を引き起こす植物病原菌から、新たなTRPチャネル「TRPGz」を発見したという。
TRPGzを出芽酵母で発現させて機能解析を行ったところ、TRPGzが生体膜外の浸透圧上昇・温度上昇・高酸化状態や、細胞内カルシウムイオン濃度上昇、膜電位変化など多様な刺激に応答してチャネルを開く、つまりTRPチャネルの基本モデルともいえる機能を有していることが判明。
さらに、TRPGzの生体膜内側に機能制御領域が存在し、浸透圧や温度上昇の刺激に応答してチャネルを開く「浸透圧・温度上昇応答モジュール」として働く領域が存在することも発見された。また、浸透圧や温度上昇などの刺激によって生体膜に一定量増加する「PIPx(ホスファチジルイノシトールリン酸)」に結合することでチャネルを閉じる「PIPx結合応答抑制モジュール」の存在も確認されたのである。
次に研究チームは、これらのモジュールを含む機能制御領域について、理研が所有する大型放射光施設「SPring-8」のビームライン「BL41XU」および「BL26B2」を用いたX線結晶構造解析や、「NMR(Nuclear Magnetic Resonance:核磁気共鳴)スペクトル測定」を実施。
なおNMRスペクトル測定の核磁気共鳴とは、原子核を強い磁場に置くと、原子核の磁気スピンが磁場に沿って整列するので、そこに特定の電磁波を照射すると、「共鳴」が起き電磁波が吸収される現象のことをいう。NMRスペクトル測定は、原子核の周囲に存在する電子の状態や原子の結合状態を知ることができるため、タンパク質の立体構造情報を知ることが可能だ。しかも、結晶構造解析と異なり、溶液中の状態でも構造を調べられるという特徴を持つ。
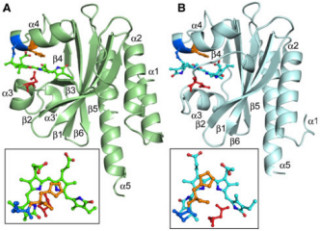
各種測定の結果、浸透圧・温度上昇応答モジュールは4本の「αへリックス構造」から構成されていて「弱い」相互作用で1つに束ねられた「ヘリックスバンドル」構造を採っていることが明らかになった(画像2)。αへリックス構造とは、タンパク質を構成するポリペプチド鎖が右巻きらせん状に折り畳まれた構造のことで、タンパク質が取る2次構造(折り畳まれた部分構造)の1種である。
これまでこのモジュールの構造はアミノ酸配列から「コイルドコイル」と呼ばれる常に「強い」相互作用で束ねられている状態であると推測されていたが、今回の解析により、常に1つに束ねられているわけではなく、必要に応じて容易にバラバラになる性質を持つことがわかったのである。そして、このモジュールが束ねられている時にだけ、TRPGz浸透圧や温度上昇に対して応答し、チャネルを開くこともわかった。
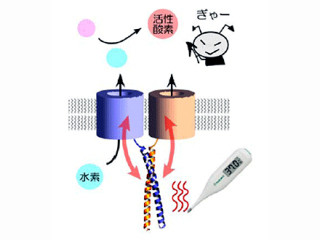
また、機能制御領域の内浸透圧・温度上昇制御モジュール以外の部分は、タンパク質が特定の立体構造を採らず、ひものようにブラブラとした柔軟な構造をしていることも判明。こうしたダイナミックな構造的特徴が、PIPx結合応答抑制モジュールなどの制御モジュールが柔軟にさまざまな刺激と反応することを可能にしており、1つのチャネルが複数の刺激に応答できる仕組みの一端となっていることが示唆されたのである(画像3)。
画像3は、今回の結果から推測されるTRPGzの機能メカニズムの模式図。浸透圧・温度上昇応答モジュールが束になっている場合に浸透圧や温度が上昇すると、チャネルが開いてイオンを通過させる(応答する)と考えられるという(図3左)。モジュールの束がほどけて、PIPx結合応答抑制モジュールが生体膜上のPIPxと結合すると、チャネルは閉じたままになり、応答が抑制される(図3中央)。また、高酸化状態、カルシウムイオン濃度上昇、膜電位変化に対しては、浸透圧・温度上昇応答モジュールが束になっていなくてもチャネルが開く(応答する)と考えられるとした(図3右)。
外界からのさまざまな刺激を感知する感覚受容は、生体反応の中でも仕組みの解明が進んでいない領域の1つだ。今回の研究により、感覚需要で重要な存在であるTRPチャネルの機能の仕組みの一端が明らかになったことは、外界からのさまざまな情報を認知する感覚受容への理解を促す1歩になると、研究チームはいう。
また、TRPチャネルの機能不全でいくつかの腎疾患などが起こることがわかっており、TRPチャネルの分子機能を応用した鎮痛薬などの治療薬の開発も進められているところだ。今回明らかになった構造的な性質も含め、今後TRPチャネルが機能する仕組みを詳しく明らかにしていくことで、これらの治療薬開発にも貢献することが期待できると、研究チームと述べている。