北海道大学(北大)は4月12日、時計遺伝子「Cryptochrome(Cry)」を欠損していることで、体内時計の機能が完全に消失して行動リズムが発現しないマウスでは、体内時計を構成する個々の時計細胞はリズム発振機能を維持しているが、個々のリズムを同期させる細胞間ネットワークが働かないために、時計機能が消失していることを見出したと発表した。
成果は、北大大学院 医学研究科の小野大輔特任助教、同・本間さと特任教授、同・本間研一客員教授らの研究チームによるもの。研究の詳細な内容は、日本時間4月10日付けで英国科学誌「Nature Communications」に掲載された。
生物は、体内時計を用いてリズムを刻み、生命活動を維持している。ほ乳類の睡眠覚醒やホルモン分泌に見られる24時間リズムを支配する体内時計が機能不全を起こすと、不眠や行動異常などのリズム障害が出現してしまう。ヒトの体の機能も、睡眠と覚醒、血圧、心拍数など、1日の中で規則的に変動している。この1日を1周期とした現象を概日(サーカディアン)リズムと呼び、脳内の視床下部に位置する「視交叉上核」が体内時計中枢として概日リズムを調節している仕組みだ。なお視交叉上核はヒトだけでなく、ほ乳類における体内時計の中枢である。
視交叉上核には沢山の概日リズムを発振する神経細胞が存在し、細胞内では時計遺伝子と呼ばれる一群の遺伝子が働いて約1日のリズムを発振する仕組みである。よって時計遺伝子が欠損すると、さまざまなリズム障害が起きてしまう。特にCryを欠損した動物は概日リズムがまったく認められないことがわかっている。しかし、これまでCry欠損がなぜリズム障害を起こすのかの仕組みそのものについてはわかっていなかった。
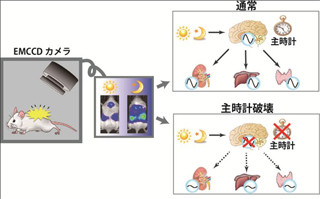
そこで研究チームは今回、時計遺伝子発現のレポーターとして生物発光を用いて、視交叉上核の組織、および細胞レベルで概日リズムの生後発達を調査。Cry欠損マウスの視交叉上核では、生後7日目までは個々の細胞リズムが同期しているが、離乳時期前後でリズムは脱同期し、体内時計として機能できない状態になることが判明したのである。
そして明らかになったことの1つが、この生後初期に見られる個々の細胞リズムの同期には神経連絡と、細胞が細胞外に分泌する物質で細胞間の情報を伝達する「液性因子」が関わっていることだ。さらに、液性因子は新生児期にのみ分泌されていること、時計機能が消失した視交叉上核に液性因子を作用させるとリズムが回復することも明らかにした。これらの結果から、視交叉上核では離乳時期にCryが働いて細胞間ネットワークを形成し、成人型の体内時計を形成することが明らかになった次第だ。
生後初期は脳内神経細胞のネットワークが劇的に変化する時期で、それに伴いさまざまな機能が形成されていくことがわかっている。研究チームは、今回の研究から、体内時計の発達を促す因子の究明、さらには、リズム障害への治療法の開発につながることが期待できるとコメント。また、新たな脳内神経ネットワークの形成メカニズムの解明につながることも期待されるとしている。