京都大学(京大)は4月2日、iPS細胞への初期化を阻害する(干渉する)因子が分化誘導を促進することを明らかにするとともに、分化細胞が初期化されるメカニズムの一端を解明したと発表した。
同成果は同大 iPS細胞研究所(CiRA)の引地貴亮 研究員、同 升井伸治 講師(JST さきがけ)らの研究グループによるもので、詳細は2013年4月1日の週(米国東部時間)に米国科学誌「Proceedings of the National Academy of Sciences」オンライン版に掲載される予定。
細胞の性質はその中で働く遺伝子の組み合わせによって決まるが、その遺伝子の制御は転写因子が行っている。そのため、多能性に関する転写因子を過剰発現させることで、体細胞をiPS細胞へと変化させることができるが、なぜiPS細胞へと初期化するのか、そのメカニズムは明らかにされていなかった。
しかし、これまで細胞を分化させる仕組みと、細胞を初期化させる仕組みとを関連付けた研究は行われこなかったことから、今回、研究グループでは細胞の種類を決定づけるようなコアとなる転写因子が存在し、それらがどの種類の細胞へと分化するかを決定すると共に、過剰に働かせるとiPS細胞への初期化を阻害すると考え、実験を行ったという。
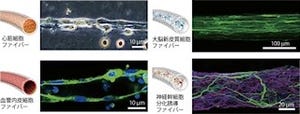
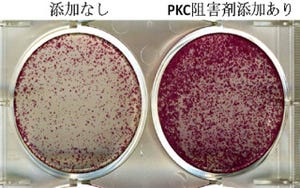
神経系の細胞(NSEB5-2C)に、初期化因子「OSKM(Oct3/4、Sox2、Klf4、c-Myc)」を導入するとiPS細胞へと初期化されることから、初期化因子に加え、網羅的解析によって明らかにした神経系細胞に特徴的な因子のうちの1つを導入する実験がはじめに実施された。これは、もしその因子が他の因子に影響を与えない因子であれば、NSEB5-2CはOSKMによって通常通り初期化されiPS細胞になるが、他の因子にも影響をあたえて神経系細胞の特徴を決定づけるようなコア因子であれば、OSKMの効果が打ち消され、iPS細胞になる確率が低くなると考えられたからで、この「iPS干渉法」を用いることでNSEB5-2Cの初期化を強く阻害する6つの因子を同定することに成功したという。
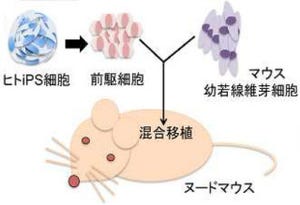
実際にこれらの因子をマウス胎児繊維芽細胞(MEF)や肝臓細胞(HNG2)などに導入したところ、細胞の形態がNSEB5-2Cに似た細胞へと変化することを確認したほか、神経系細胞に特徴的な遺伝子であるNestinの発現も確認したとする。また、肝臓の細胞(HNG2)でiPS干渉実験を行ったところ、肝臓細胞への分化を促進することが知られている4つの因子(Foxa2、Hnf4a、Foxa3、Hnf1a)は、いずれもHNG2のiPS細胞化を強く阻害することが確認され、これらの結果から、初期化を阻害する因子は、細胞の分化の方向性を決める重要な因子であることが示されたと研究グループでは説明する。
これらの成果を受けて研究グループでは、分化細胞が初期化されるメカニズムは、分化細胞に特徴的な遺伝子群が分化を維持する働き(初期化を阻害する働き)をしており、初期化因子であるOSKMを作用させると、分化細胞に特徴的な遺伝子の働きが弱くなることで初期化が進むと結論付けたという。
今回の成果を受けて研究グループでは、今回用いられたiPS干渉法について、神経細胞以外の他の種類の細胞でも同様に利用することができ、細胞の初期化や分化のメカニズムを明らかにするために有効なツールとして利用できると考えられると説明する。例えば、分化した細胞からiPS細胞が作製される仕組みの理解が進み、より高品質なiPS細胞を作る技術開発につながるほか、分化した細胞を特徴づける遺伝子の働きを明らかにすることで、各種細胞を効率よく作る技術の開発につながることから、iPS細胞を利用した新薬の創出や再生医療に貢献することが期待できるとコメントしている。