理化学研究所(理研)と大阪大学(阪大)は、横河電機、コヒレント・ジャパンの協力を得て、生物個体や組織など、厚みがある試料内部の高速・高精細に蛍光イメージングを可能とする装置として、2光子励起を適用した「スピニングディスク共焦点顕微鏡」を開発したと発表した。
成果は、理研 発生・再生科学総合研究センター 光学イメージング解析ユニットの清末優子ユニットリーダー、同・下澤東吾研究員と、同・形態形成シグナル研究グループの近藤武史基礎科学特別研究員、同・非対称細胞分裂研究グループの下向敦範専門職研究員、同・今野大治郎研究員、同・生命システム研究センター 発生動態研究チームの髙山順特別研究員、先端バイオイメージング研究チームの渡邉朋信チームリーダー、阪大大学院 工学研究科の藤田克昌准教授、同・大学 微生物病研究所の山縣一夫特任准教授らの共同研究グループによるもの。研究の詳細な内容は、2月11日の週に米国科学雑誌「米科学アカデミー紀要(PNAS)」に掲載される予定だ。
近年の科学技術の発達に伴い、培養細胞を用いた細胞生物学研究では、複数の点を同時に励起する多点走査方式を用いた「スピニングディスク型共焦点顕微鏡」を活用することで、従来の「シングル・ビーム共焦点顕微鏡」と比べ20~50倍という速さで観察することが可能なほか、デジタル撮影のため、低ノイズ、高諧調画像を取得できる「共焦点顕微鏡解析」が実現されるようになったが、多点走査方式では各励起点とその上下の非焦点面で発生する蛍光が各ピンホールに混入し交差してしまう「ピンホール・クロストーク」が生じ、共焦点性が失われてしまうため、個体や組織などの厚みがある試料への適用は難しかった。
そこで研究グループは今回、高速性を維持しつつ、生体内部まで高精細に解析可能なイメージング装置の開発を目指して、スピニングディスク型共焦点顕微鏡の改良を試みたという。
今回考えられた改善策は、多点走査方式の問題点であるピンホール・クロストークを、ピンホールの間隔を広げて非焦点面からの背景光の混入を減少させること、ならびに平面選択的な「2光子励起法」を適用し、非焦点面での蛍光発生を根本的に抑えることの2点。
具体的な手法としては、従来の「スピニングディスク共焦点スキャンユニット」にある「ピンホールアレイディスク」のピンホール間隔を約2倍にし、2光子励起の効率を上げるためにピンホールアレイディスクの上に搭載した集光レンズ(マイクロレンズ)の直径も約2倍に改良したほか、ピンホール・サイズの影響を調べるため、ピンホール直径が55μmと100μmのピンホールアレイディスクを作製し、従来用いられてきた「1光子励起法」と、2光子励起法それぞれの場合を比較・評価を行ったという。
実際の評価では、新開発のスピニングアレイディスクと2光子励起の組み合わせでは、期待通りにピンホール・クロストークの抑制が確認されたほか、ピンホール直径が100μmのアレイディスクに比べて55μmでは、ピンホール・クロストークの抑制および光軸方向の分解能向上に効果があることが確認され、ピンホール直径は小さな方がよいことが確認されたという。
|
|
|
画像2。従来型(左)と新型(右)で撮影した花粉の3次元画像の比較。カボチャの花粉をそれぞれ撮影、花粉全体をスキャンし、3次元画像を再構築して花粉の断面を表示したもの。新型の方が従来型と比較して詳細に花粉を観察できる様子が見れとれる |
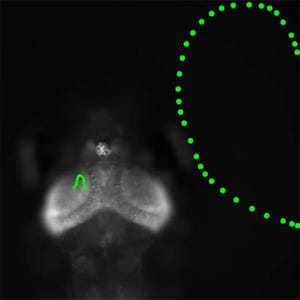
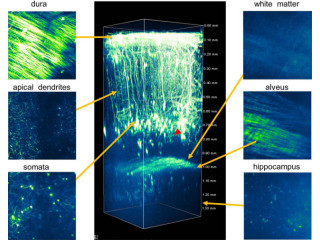
さらに、より実践的な厚みのある生体試料としてGFP融合タンパク質を発現させたマウスやショウジョウバエなどの胚や卵を用いて、ピンホール直径55μmのピンホールアレイディスクと2光子励起法の評価を実施したところ、例えば、GFP融合タンパク質により細胞内にある核を可視化したマウス胚切片の前脳領域では、従来型では核の形状がノイズに埋もれて約30μmの深部では判別できなくなるのに対し、新型では100μm以上の深部までの可視化に成功したほか、GFP融合タンパク質により細胞膜を可視化したショウジョウバエ胚では、80μm以上深部にある細胞の輪郭を詳細に観察することにも成功。これにより、従来型に比べてコントラスト比を30倍以上改善できることが確認された。
|
|
|
画像3。GFP融合タンパク質を発現するマウス胚の切片を作製し、頭部前脳領域を従来型と新型で撮影したもの。従来型では、背景光の増加により約30μmの深部で核の形状が見分けられなくなるが、新型では100μmの深部でも核を判別することが可能で、レーザー強度を上げることができれば、さらなるシグナルの向上が可能となるという |
このほか、ショウジョウバエ胚を用いて、新型装置と従来装置(シングル・ビーム共焦点顕微鏡)で、1光子励起、および2光子励起をそれぞれ適用し撮影した3次元画像の解像度を比較したところ、新型装置に2光子励起を適用した時が、最も高精細な3次元像を構築できることが確認されたするほか、生きたショウジョウバエ胚やマウス卵の内部で、微小管伸長マーカー「EB1-GFP」を用いて、直径25nmの微小管の伸長の可視化にも成功しており、ライブイメージングにも応用可能であることが示されたとする。
なお、今回開発された方式はレーザー光を広げて面で照射するため、高出力のレーザーが必要となる。今回は現時点で入手可能な最高出力の2光子励起用レーザーを用いたが、視野の10%以下の領域でしかGFPを励起することができなかったと研究グループでは説明しており、今後は既存のレーザーよりも5~10倍出力が高いレーザーを実現することで、広視野観察や、GFPと赤色蛍光タンパク質との2色観察が可能となるとしている。また、イメージングの高速・高精細化は、ライブイメージングのみならず、組織透明化試薬などを用いて透過性をよくした大きな試料全体を3次元的にスキャンし、精密な立体画像を再構築するといった最新のイメージング技術にも最適だとしており、今後、基礎研究のみならず応用研究や医療など、幅広いライフサイエンス研究分野の発展に貢献することが期待できるとコメントしている。