京都大学は10月5日、精子幹細胞移植法における「ホーミング」に関わる分子機構について、今回新たに「GDNF」と「CXCL12」という細胞の遊走を促すタンパク質であるケモカイン(走化性因子)の関与を明らかにしたと発表した。
成果は、京大医学研究科の篠原美都助教、同・篠原隆司教授、理化学研究所 遺伝子工学基盤技術室の小倉淳郎室長らの共同研究グループによるもの。研究の詳細な内容は、米国科学誌「Cell Stem Cell」10月5日号に掲載された。
ホーミングとは、精子幹細胞移植法において、「精細管内腔」に注入された幹細胞が、精細管の「基底幕」側にある「幹細胞ニッシェ」にたどり着く現象のことをいう。そのニッシェで生息しているのが幹細胞だ。
そしてニッシェは、幹細胞の増殖や分化に必要な栄養素やシグナルを提供する、重要な働きをしている。骨髄移植では血液幹細胞がレシピエント(ドナーに提供を受ける側)の体内で造血を起こすには、ホーミングによりニッシェに到達して増殖することが必要だ。幹細胞を引き寄せる働きをしているのが、ケモカインがニッシェで発現することと考えられている。
また精子形成の源である幹細胞の精子幹細胞は骨髄移植と同様に、精巣内に移植するとニッシェに到達して生着し、ドナー細胞由来の精子形成をすることが可能だ。
研究グループは、そのプロセスに血液幹細胞のホーミング現象と類似したケモカインの関与があるのではないかと考えた。候補と考えられる物質の効果を調べるため、試験管内でホーミング現象を模倣した培養系が開発された。
研究グループは、2003年に精子幹細胞の長期培養系を報告した経緯がある。この培養系「Germline Stem(GS細胞)」では、「Glial cell-line derived neurotrophic factor(GDNF:精子幹細胞の自己複製因子)」の存在化で、精巣細胞を胎児由来の「線維芽細胞(mouse embryonic fibroblast:MEF)」の上で培養すると、フィーダー細胞の上で盛り上がった形のコロニーを形成して2年以上増殖し、精巣内に移植すると精子を形成することができるというものだ。
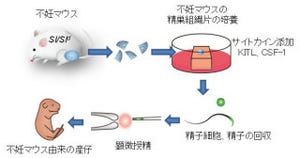
今回の研究ではMEFではなく、精巣の体細胞をフィーダーに用いた。精子形成のない不妊マウスの精巣細胞を培養し、精巣の主要な支持細胞である「セルトリ細胞」が広がった状態をまず作出し(これを精巣フィーダー細胞という)、その上にGS細胞を播種(はしゅ)すると、セルトリ細胞の上だけでなく下にも潜り込み「敷石状コロニー」を作ることが確認された。
骨髄細胞の培養では骨髄の支持細胞が広がった層の下に、血液幹細胞や前駆細胞が敷石状コロニーを形成することが知られており、試験管内で骨髄細胞によって再構成された幹細胞ニッシェに幹細胞がホーミングしたものと考えられている。
幹細胞活性の試験管内判定の手段としても使われ、特に移植アッセイの行えないヒトの造血活性の測定に極めて有用とされてきた。今回、研究グループが観察した敷石状コロニーは、造血系で見られるものと形がとても似ており、造血系と同様に精子幹細胞のニッシェの再構成とホーミングが起きた結果と考えられている。
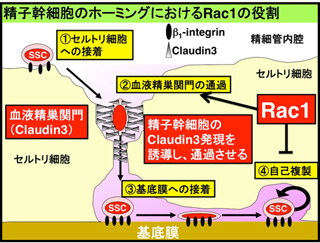
その考えを支持しているのが、以下に挙げる実験結果だ。1つ目は、これまでの研究で、精子幹細胞のホーミングには接着分子の「インテグリン」が必要であることがわかっているが、「Integrin B1」の欠損したGS細胞では敷石状コロニーの形成率が低下していたことだ。
2つ目は、GS細胞だけでなく精巣の精子幹細胞も敷石状コロニーを形成したことである。
そして3つ目が、精巣の細胞から「抗Integrin A6抗体」を使って幹細胞を濃縮したところ、精巣内移植によるコロニー形成率と試験管内での敷石状コロニー形成率の両方が上昇していたことだ。
この培養系で用いた精巣フィーダー細胞は、不妊マウスの精巣を無血清培地で培養した後、細胞の増殖能を抑えるため「Mytomycin C」で処理し、細胞外基質「ラミニン」でコートされた培養皿の上に播種したものである。
免疫染色でどのような細胞からフィーダーが構成されているか調べて見ると、大部分にセルトリ細胞が広がっており、一部に「ライディッヒ細胞」や「筋様細胞」も認められた。しかし、敷石状コロニーが形成される部位とこれらの細胞の分布に相関があるかは判明しなかったという。
続いて研究グループは、精巣フィーダー細胞を用いて、精子幹細胞のホーミング活性に影響する因子をスクリーニングを実施。EGFP(enhanced green fluorescent protein:高感度緑色蛍光タンパク質)を発現するGS細胞をさまざまな培養条件下で精巣フィーダー細胞に播種し、形成される敷石状コロニーの数が測定された。
そして以下の結果から、精子幹細胞の自己複製因子として知られてきたGDNF(glial cell-line derived neurotrophic factor:精子幹細胞の自己複製因子)がホーミングを促進することが判明したのである。
1つ目は、GDNFの培養中への添加により敷石状コロニー形成が亢進し、逆にGDNFへの中和抗体により低下したこと。
2つ目は、GDNFの受容体「Ret」の「dominant negative体」にてGDNFシグナルを阻害すると、敷石状コロニーおよび移植精巣でのコロニーの形成が低下したことだ。
GDNFは精子幹細胞の自己複製増殖を促進するサイトカインとして知られてきたが、神経細胞などでは増殖の促進以外に、細胞の遊走を促すケモカインとしての働きもあることが知られている。今回の研究の結果は、精子幹細胞でもGDNFが両方の作用を持つことを明らかにした。
また、血液幹細胞や「始原生殖細胞」のホーミングに関与すると報告されている「CXCL12」が、精子幹細胞のホーミングも促進することが以下の結果から明らかにされた形だ。
まず1つ目が、CXCL12の培養中への添加により敷石状コロニー形成が亢進し、逆にCXCL12への中和抗体により低下したこと。
2つ目は、CXCL12の受容体「CXCR4」のノックアウトマウスから、CXCR4欠損した精子幹細胞を採取し、ホーミング活性が調べられたところ、敷石状コロニーおよび移植によるコロニー形成が低下したことだ。
そして3つ目が、CXCL12を精巣の支持細胞(セルトリ細胞)に高発現させ、その精巣をホストとして精子幹細胞を移植すると、コロニー形成が亢進したことである。
CXCL12は別名「SDF-1」とも呼ばれ、1994年に今回の研究グループの一員でもある長澤丘司教授らが発見した。CXCL12は造血系の細胞を骨髄ニッシェへ誘導するケモカインであることがわかり、その阻害剤「AMD3100」も含め、臨床で広く用いられている。
さらに、長澤教授らはCXCL12が胎生期の生殖細胞を生殖腺へと誘導する働きもしていることを2003年に報告しているが、生後の生殖細胞での関与はわかっていなかった。今回、初めてCXCL12の作用が成人の精巣でもニッシェへのホーミングという形で続いていることが証明されたというわけだ。
さらに研究グループは、GS細胞におけるCXCR4(CXCL12の受容体)の発現量がGDNFによって亢進することが発見した。これらのことからGDNFやCXCL12がニッシェにおいて発現し、両方のシグナルが協調して精子幹細胞のホーミング活性を高めることが明らかになったのである。
なお研究グループは今回の成果において、次のことをまとめている。1つ目はホーミングシグナルの解明の意義だ。精子幹細胞の移植による生着率はマウスでも5~10%と低く、さらにほかの動物種では著しく低いため、実用化を阻んでいるのが現状だ。
男性不妊症の治療や、家畜や遺伝子改変動物作成のために、この移植法を実用化するには移植効率の改善が必須だ。特に小児のがん治療の副作用である男性不妊症に対しては、精子の保存ができないため、精子幹細胞の保存とがん治療後の自家移植が有効な手段として期待され、ホーミングの分子機構の解明は移植効率の改善に役立つと期待されているとする。
2つ目のニッシェの再構成系の確立の意義について。これまで移植だけが精子幹細胞活性を機能的にアッセイする手段だったが、この培養系の確立により、試験管内でのアッセイが可能となった。
移植によるアッセイが幹細胞活性のスタンダードの基準であることに変わりないが、移植より迅速(2カ月vs1~2週間)、かつ安価で容易に行えること、またヒトなど移植法の確立していない動物種で幹細胞活性を判定するのに有効であるなどの利点があるとする。
また、精巣内のニッシェは遺伝子操作や観察が困難だが、試験管内でニッシェを再構成できたことで、ニッシェの作用や幹細胞の動態に及ぼす影響を試験管内の実験で解析できるようになったことも挙げた。