科学技術振興機構(JST)と神戸大学は、がん組織で高頻度に認められるミトコンドリアの機能低下が周辺組織の悪性化(がん化)を促進することを発見し、その仕組みを解明したと共同で発表した。
成果は、神戸大の井垣達吏准教授らの研究グループによるもの。研究はJST課題達成型基礎研究の一環として行われ、詳細な内容は英国時間9月30日付けで英国科学誌「Nature」オンライン速報版に掲載された。
がん(悪性腫瘍)とは、腫瘍の中でも異常に増殖し、かつ周辺組織に浸潤したり(浸潤能)、遠隔組織に転移したり(転移能)する細胞集団のことだ。がんのほとんどは上皮組織に生じる。正常な上皮細胞に複数の遺伝子変異が起こることで前がん細胞となり、さらに前がん細胞が過剰に増殖して良性腫瘍が形成される。
良性腫瘍は、組織浸潤能・転移能を持たない細胞集団で、異常な増殖を起こすものの、発生した場所から移動することはない。この良性腫瘍にさらに遺伝子変異が加わることで、組織浸潤能・転移能を持つがんが生じると考えられている(画像1・2)。
腫瘍が組織浸潤能・転移能を持つようになることを、腫瘍の悪性化(がん化)と呼ぶ。これまで、このような腫瘍のがん化を促すさまざまな遺伝子変異について多くの研究がなされてきたが、近年、細胞が分泌するタンパク質ががん化を促進する機能を持つことが知られるようになり、前がん細胞や正常細胞が互いに影響を及ぼし合うことによってもがん化が促進されると考えられるようになった(画像2)。
しかし、生体内で細胞同士がどのように相互作用してがん化が促進するのか、その仕組みを解明する研究はこれまでほとんどなされていない。その理由として、細胞同士の相互作用とそれによるがん化のメカニズムを哺乳類の生体内で解析することが技術的に困難であったことが大きな理由だ。
がん細胞に生じる遺伝子変異は多様だが、その中でも細胞内でエネルギー生産を担うミトコンドリアという構造体の機能低下を招く遺伝子変異は、多くのがんに共通して生じていることが知られている。しかし、ミトコンドリアの機能低下とがんの発生、進行との関係は、ほとんどわかっていなかった。
研究グループは今回のモデルとして、細胞間の相互作用を生体内で解析することが可能なショウジョウバエを利用。ショウジョウバエでは近年、生きた個体内で複数の細胞集団に異なる遺伝子操作を行う「遺伝的モザイク法」の技術が確立されており、生体内で細胞同士の相互作用を解析することが可能だ。
研究の結果、次のことが明らかになった。前がん状態の良性腫瘍中のある細胞の中で、「Ras(ラス)遺伝子」の活性化とミトコンドリア機能低下が同時に起こると、細胞内のストレスを感知する情報伝達経路が活性化し、細胞外に「炎症性サイトカイン」と「細胞増殖因子」の2種類のタンパク質が放出される。放出されたタンパク質は良性腫瘍内のほかの細胞を刺激し、細胞増殖能、組織浸潤能・転移能を増加させることでがん化を招くというものだ。
今回の研究の成果は、がん細胞中のミトコンドリア機能低下ががん化やがんの進行にどのように関わっているかを示した点、しかもその具体的な仕組みを解明した点、さらにこれを生体中で証明した点で、世界で初めてとなる。
今回の研究の詳細は、以下の通りだ。まず、細胞同士の相互作用によって起こるがん化のメカニズムを明らかにするため、生きたショウジョウバエ個体の上皮組織において、細胞が自分自身ではなく周りの細胞の増殖を促進するようになる遺伝子変異を探索した。
ヒトのがんの約3割で活性が高まっているがん遺伝子Rasをショウジョウバエの上皮組織で活性化させると、良性腫瘍が形成される。この良性腫瘍に約3000種類の遺伝子変異をランダムに1つずつ導入し、良性腫瘍が変化する様子を観察した。
その結果、「ミトコンドリア呼吸鎖」の機能障害を起こすような遺伝子変異が良性腫瘍に導入されると、その良性腫瘍自身ではなく近隣細胞の増殖能が高まることが発見されたのである(画像3)。
さらにこの時、近隣細胞においてもRas遺伝子の活性が高まっていると、それら近隣細胞は悪性化(がん化)して浸潤・転移能を獲得することがわかった(画像4)。
画像3は、周辺細胞の増殖を促す遺伝子変異の探索。(1)ショウジョウバエの上皮組織(水色)の一部の細胞でRasの活性を高めると、良性腫瘍(緑色)が形成される。(2)この良性腫瘍にさらにミトコンドリアの機能障害を起こすような変異が加わると、周辺細胞の増殖能が高まるのである。
画像4は、ミトコンドリア機能障害が周辺の良性腫瘍を悪性化する様子。ショウジョウバエ幼虫の複眼前駆組織(上皮組織の1種)にRas遺伝子を導入してその活性を高めると、良性腫瘍が形成される。この場合、良性腫瘍は眼組織内に留まり、神経組織へ浸潤・転移することはない。また、このRasを活性化した良性腫瘍の中の一部に、Rasの活性化と共にミトコンドリアの機能低下を同時に起こした細胞集団を導入すると、周辺のRasのみを活性化した良性腫瘍が悪性化(がん化)して神経組織へと浸潤・転移することがわかったのである。
ミトコンドリアの機能障害が近隣細胞のがん化を促す仕組みを明らかにするため、次にこの現象を引き起こすのに必要な遺伝子の探索が行われた。具体的には、Rasの機能亢進とミトコンドリアの機能障害を同時に持つ細胞の中でさまざまな遺伝子の機能を不活化し、周辺組織のがん化が起こらなくなるものが探索された形だ。
その結果、遺伝子「stat」が不活化すると、周辺組織のがん化が起こらなくなることが突き止められたのである。statは細胞の増殖を促すタンパク質で、「アンペアード」(哺乳類では「IL(インターロイキン)-6」)と呼ばれる炎症性サイトカインによって活性化されることが知られていた。
実際、Rasの機能亢進とミトコンドリアの機能障害を同時に持つ細胞の中でアンペアード遺伝子の発現が高まっており、この細胞内でアンペアードの発現を抑制すると周辺細胞のがん化が起こらなくなることが確認されたのである。
さらに、アンペアード遺伝子の発現が高まる仕組みについての解析も行われた。その結果、Rasの機能亢進とミトコンドリアの機能障害を同時に持つ細胞では酸化ストレスを起こす活性酸素種が大量に産生され、これによって細胞ストレスに応答するリン酸化酵素「JNK」が活性化することがわかったのである。
それに加えて、JNKとRasが同時に活性化すると「Hippo(ヒポ)経路」と呼ばれるがん抑制経路が不活性化されることも判明。ヒポ経路は通常、アンペアード遺伝子や分泌性の細胞増殖因子「ウィングレス」(哺乳類では「Wnt(ウィント)」)遺伝子の発現を抑制している。
したがって、ヒポ経路が不活性化することでアンペアード(IL-6)やウィングレス(Wnt)の発現が高まり、これらが周辺細胞に作用してがん化を促すことがわかった。
さらに、ウィングレス(Wnt)は細胞増殖の亢進を、アンペアード(IL-6)は細胞増殖の亢進と悪性化(浸潤・転移能の付与)の両方を引き起こすことも確認されたのである(画像5・6)。
このようなRasの機能亢進とミトコンドリアの機能障害を同時に持つ細胞は死ににくく、長期に渡ってアンペアード(IL-6)やウィングレス(Wnt)を産生・分泌し続けると考えられることから、これら分泌性タンパク質による慢性的な刺激が周辺細胞のがん化を促すものと考えられるという。
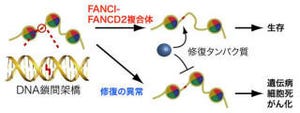
以上のように、良性腫瘍の中のある細胞にミトコンドリアの機能低下が起こると、その細胞が分泌性タンパク質を産生・放出し、これによってその近隣の良性腫瘍が悪性化(がん化)することが初めてわかった(画像7)。
この研究は、ショウジョウバエをモデルとして用いることではじめて成し得たもので、これまで難題であった前がん細胞同士の相互作用によるがん化のメカニズムの1つが明らかとなった次第だ。
|
|
|
画像7。今回明らかになったがん化促進の仕組み。良性腫瘍の中のある細胞にミトコンドリアの機能低下が起こると、その細胞が分泌性タンパク質を産生・放出し、これによってその近隣の良性腫瘍が悪性化(がん化)する |
がん組織でミトコンドリアの機能が低下していることは10年以上も前から知られていたが、その意味はこれまでほとんど不明だった。今回明らかになったミトコンドリアの機能低下によるがん化の仕組みは、例えば悪性度が高いことで知られる膵臓がんで重要な役割を果たしている可能性が考えられる。
なぜなら、膵臓がんではミトコンドリアDNAにコードされるミトコンドリア呼吸鎖複合体遺伝子に高頻度に変異が入っていることが知られており(すなわちミトコンドリアの機能が低下していると考えられており)、また、膵臓がんの約9割はRas遺伝子の活性が高まっていることもわかっているからだ。
これまでのがん治療は、がん細胞をいかに生体から除去するかに主眼が置かれてきたが、そのような戦略では、がんの最大の脅威である再発や転移に対して大きな効果を発揮することができていない。
今回明らかとなった細胞間の相互作用を介したがん化のメカニズムは、遺伝子変異の蓄積によるがん化のメカニズムとは異なり、がんの再発や転移における腫瘍の悪性化メカニズムに重要な役割を果たしている可能性が考えられるという。
今後、ショウジョウバエで明らかになったメカニズムを哺乳類の実験系で確認することで、ミトコンドリア機能障害やそれによって炎症性サイトカインや細胞増殖因子が放出される機構、すなわち前がん細胞同士の相互作用を標的とした、これまでにない新しいがん治療法の確立が期待されると、研究グループはコメントしている。