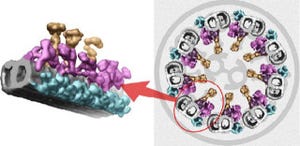
理化学研究所(理研)は9月21日、網羅的に測定した遺伝子発現情報を3次元空間に再構成する手法「トランスクリプトームトモグラフィー」を開発し、生体内のどの部分で、どの遺伝子が、どれだけ発現しているかを、Web上の仮想空間で描くことに成功したこと、ならびに同手法で作成したマウスの脳遺伝子発現データベース(ViBrism-DB)を、Web上にて公開したことを発表した。同成果は理研基幹研究所 生物情報基盤構築チームの於保祐子 客員研究員(NPO法人BReNt-ブレインリサーチネットワーク代表)、横田秀夫チームヘッド、理研情報基盤センターの姫野龍太郎センター長らによる成果で、米国のオンライン科学雑誌「PLOS ONE」に掲載された。
生物の設計図にあたる全遺伝情報(ゲノムDNA)の解読が進み、ヒトやマウスなどでは、1つの細胞の中に約数万種類のタンパク質をコードする遺伝子や生命活動に重要な役割を担うRNA分子が存在していることが分かってきた。
RNAの情報に基づいてタンパク質が合成されるが、一部のRNAは、RNA分子として存在し生命活動を維持するために重要な働きをする。近年の技術進歩により、ごく少数の細胞から、その中にあるほぼすべての転写産物について網羅的に測定できるようになってきた。例えばマイクロアレイやRNA-シークエンス法などを用いることで、複雑な形をした臓器や生体全体を対象として、「トランスクリプトーム」(細胞中にはさまざまなRNAがそれぞれの量で存在しており、このようなRNA分子の総体。また、ゲノムDNAの一部を鋳型にしてRNAが合成されることを転写(トランスクリプション)と呼び、転写によって合成されたRNAのことを転写産物(トランスクリプト)と呼ぶ)を調べることができるようになっている。この際、測定に使った細胞がどこにあったのかという位置情報を正確に知る必要があるが、従来の方法では位置測定が2次元的で、正確な3次元化は困難であった。3次元化に向け測定対象をサイコロ状に切断する方法も試みられたが、位置合わせが困難なほか、測定精度を上げようとサイコロのサイズを小さくすると、試料数が膨大になるという欠点があったことから、トランスクリプトーム解析で得られる網羅的なデータを、迅速・高精度に3次元空間に再構成する新たな技術の実現が求められていた。
研究チームはこれまでに、生体の内部構造を観察するための3次元内部構造顕微鏡「3D-ISM」を開発していた。3D-ISMは、カミソリのような鋭い刃で生体組織試料などの対象を5μm程度にごく薄く切断し、そのときの切断面の画像情報を得る、という繰り返し過程を自動制御するシステムで、同過程を対象全体に繰り返し、得られた数千枚の画像情報をコンピュータ上で積み重ねることで、外形と内部の構造を3次元で捉えることができる。こうして出来上がった3次元画像は、コンピュータ上の仮想空間での再現ながら、対象が実空間にある時と同じように、どの方向からのどの断面でも観察することが可能となっている。
今回開発されたトランスクリプトームトモグラフィーは、3D-ISMの観察過程で切り出されたごく薄い切断片を数百枚ずつ集めて分画とし、これをマイクロアレイなどの網羅的かつ高速な発現量測定技術で解析する手法だ。少なくとも3つの生体組織試料を用意し、縦・横・高さ方向の分画について定量計測してトモグラフィーにより解析することで、遺伝子の発現量について立体的な分布を得ることができる。
実際に、実験動物として最もよく使われるマウスの脳を用いて、脳全体を1mm刻みで平均10分画(6~13分画)に分け、各分画についてマイクロアレイでほぼすべての遺伝子の発現量を解析、36,558種類の発現分布地図を作成したところ、その精度は、従来の2次元的な方法で作成、公開されているアレンブレインアトラス(Allen Brain Atlas:ABA)とほぼ同程度だったにもかかわらず、作成に要した脳試料数はABAが数千に対し同手法では6つ、費用面ではABAが数億円かかるのに対し同手法では数百万円と大幅な削減が可能なほか、時間面でもABAが1年かかるのに対し同手法は1カ月程度でできることが判明したという。
また、マウス脳の一部を実際にヒトの手で丁寧に切り取り、その場所の遺伝子発現量を網羅的に測定したブレインスターズ(BrainStars)と比較しても、測定結果はよく一致することが確認されたという。特に、実際に使用した試料数はほぼ同数ながら、ブレインスターズが特定の脳領域だけを対象としているのに対し、同手法は脳全体を同等の精度でくまなく測定することができたとする。
さらに、測定した1つひとつの遺伝子について、同一の3次元空間で定量的に解析することが可能であるため、難治性の脳疾患であるハンチントン病の遺伝子Httが高発現している分布と、その疾患による脳の障害が起きている部分に相関があること、また、この疾患の進行を遅らせる可能性があると知られている遺伝子Bdnfが多く発現する脳部位は、Httが高発現していてもその障害の程度が低い傾向にあることも突き止めたという。
|
|
|
図3 ハンチントン病遺伝子(Htt)発現量と脳障害程度の関係。Aは遺伝子Httが多く発現する脳部位(赤い部分)と既知の脳の障害程度に相関があることを示している。一方のBは病気の進行を遅らせる可能性のある遺伝子Bdnfが多く発現する脳部位(赤い部分)は、Httが多く発現(96±2.3%)していても障害の程度が低い(+)傾向にあることを示している(出所:理研Webサイト) |
トランスクリプトームトモグラフィーで作成された3次元情報は、MRIなどの他の生物学的情報と同一の3次元空間で解析することが可能だ。特に脳科学の分野では、標準的な脳空間をWeb上に設定して、そこに多くの情報を再現することで、研究成果を統合して複雑な脳機能の理解を深めようというデジタル脳図譜作成プログラムが加速していることから、同手法を、こうした新しい脳科学研究に対して適用することで新たな発見などが期待できるという。
|
|
|
図4 Web上のマウス脳共通空間(WHS:Waxholm Space)でMRI画像に遺伝子発現解析を統合した図。ハンチントン病によって最も障害を受けると考えられるHtt強発現Bdnf低発現領域を、マウス脳MRI画像に基づき脳部位ごとに色分けすると(赤~青)、線条体(23)などの障害部位がどの程度含まれるかが分かる(出所:理化研Webサイト) |
また、研究者が各自の研究テーマごとにトランスクリプトームデータベースを作成し、Web上に公開した標準空間にアップロードすることで、研究者間でこれらを比較検討し、解析することも可能となるという。これは、現在のゲノム解析について1次元で行われている研究を3次元に拡大するものであり、研究の相乗効果によって革新的な成果が生まれることが予想できると研究グループではコメント。さらに、同じ検体から、遺伝子以外の生体内高分子の測定も可能なため、生命現象や病気の状態を分子レベルで理解することができ、特に、疾患モデル動物などの詳細かつ網羅的な解析に応用できることから、さまざまな疾患の解明に貢献することが期待できるとしている。