千葉大学は、かずさDNA研究所との共同研究により、免疫抑制作用を持つ液性因子「TGF-β」が、アレルギー性炎症の発症を抑える分子機構を解明したと発表した。
成果は、千葉大大学院 医学研究院の中山俊憲教授、かずさDNA研究所の山下政克室長らの共同研究グループによるもの。研究の詳細な内容は、英国時間7月1日付けで英科学誌「Nature Immunology」オンライン速報版に掲載された。
花粉症や喘息、アトピー性皮膚炎などをはじめとするアレルギー疾患は、世界的に増加の一途をたどっており、日本でも、国民の約3割が何らかのアレルギー症状を示す状態になっている。
アレルギー疾患は根治療法が確立されていないことから、一旦発症すると慢性化することが多く、治療が長期にわたってしまう。そのため、患者の肉体的、精神的、経済的な負担が大きくなることから、現代医学が解決すべき課題の1つとなっている。
アレルギー疾患の発症や病態には、「CD4陽性ヘルパーT(Th)細胞」サブセットの1つである「Th2細胞」の過剰な活性化が深く関わっている。Th細胞は免疫反応の司令塔ともいえる細胞であり、産生する「サイトカイン」の種類によって、「Th1」、Th2、「Th17細胞」の少なくとも3種類に分類されるのが確認済みだ(画像1)。
また、免疫反応の収束や抑制に関わる、「Treg(RegulatoryT)細胞」も同定されている。これらのT細胞は、通常は互いにバランスを取りながら正常な免疫反応を担っているが、サブセット間のバランスが崩れてTh2細胞優位になった場合に、アレルギー疾患が発症すると推察されているところだ。
画像2に示されているように、Th2細胞は、「インターロイキン(IL)-4」や、「IL-5」、「IL-13」といったサイトカイン(Th2サイトカイン)の分泌を介して、「IgE」産生や「好酸球」の遊走・組織浸潤、気道過敏性の亢進を誘発することから、アレルギー疾患の根幹に位置する細胞であるといえる。
研究グループは、このTh2細胞の分化や機能を制御することによりアレルギー反応の抑制が可能となり、将来的には難治性の慢性アレルギー疾患の根治療法の開発につながると考えて、研究を行ってきた。
抑制性サイトカインであるTGF-βは、T細胞の活性化や増殖を直接阻害したり、Treg細胞を誘導したりすることで、急性のみならず慢性の炎症も抑制することが知られている。
またTGF-βは、Th細胞サブセットの中でもTh2細胞の分化や機能を強く阻害することが報告されていたが、そのTh2細胞選択的な作用の分子機構については明らかになっていなかった。
そこで、研究グループは今回、TGF-βのTh2細胞選択的抑制の分子機構を解明することが、新たな慢性難治性アレルギー疾患の制御法の開発につながると考えて、研究が行われた次第だ。
まず、Th2細胞をTGF-β処理することで新たに誘導される遺伝子を検索し、「sry型転写因子」のファミリーに属する転写因子「Sox4」を新たに同定した(画像3)。この分子は、iPS細胞誘導で有名な「Sox2」と同じファミリーに属する転写因子だ。
TGF-βによるTh2細胞からのTh2サイトカイン産生抑制へのSox4の関与について、ノックダウンアッセイで検討したところ、Sox4のノックダウンでTGF-βによるTh2サイトカイン産生の抑制が部分的に解除された(画像4)。
このことにより、Th細胞をTGF-β刺激することで誘導されるSox4が、TGF-βによるTh2細胞の分化・機能の抑制に関わっていることを世界で初めて確認したのである。
アレルギー疾患におけるSox4の関与について、さらに詳しく解析するため、研究グループは、T細胞特異的にSox4を過剰発現したマウスとT細胞特異的にSox4を欠損したマウスを使って、マウスを「卵白アルブミン(OVA)誘発マウスアレルギー性気道炎症(マウス喘息モデル)」の発症と病態についての検討を行った。
OVAで免疫した後、経気道的にOVAを吸入させて喘息反応を誘導したところ、期待通り、アレルギーの指標である気道肺胞洗浄液中への好酸球浸潤や気道過敏性の亢進が、Sox4の過剰発現マウスでは強く抑制され(画像5)、逆に欠損マウスでは症状の亢進が見られた(画像6)。この実験により、Sox4が個体レベルでもアレルギー反応の抑制に関わっていることが証明されたのである。
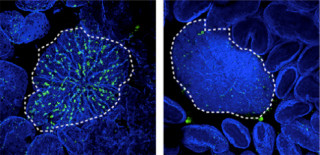
画像5は、Sox4トランスジェニック(TG)マウス(過剰発現マウス)では、マウスアレルギー性気道炎症モデルの病態が改善するという様子を撮影した顕微鏡画像と結果をまとめたグラフだ。
詳しくは、まず(A)が、マウス肺の組織学的分析(炎症細胞浸潤)。Sox4TGマウスでは、細気管支周囲への炎症細胞浸潤が顕著に減少した結果を撮影したもの。(B)は、Sox4TGマウスでは、アレルギー炎症で誘導される気管支からの粘液産生(矢印の濃い紫色の部分)の亢進が衰弱する結果を撮影したものだ。(C)は、Sox4TGマウスでは、アレルギー炎症に伴う気道過敏性の亢進が衰弱するという結果をまとめたグラフ。
画像6は、Sox4ノックアウトマウスでは、マウスアレルギー性気道炎症モデルの病態が増悪するという様子を撮影した顕微鏡画像と結果をまとめたグラフ。
(A)は、マウス肺の組織学的分析(炎症細胞浸潤)を撮影したもので、Sox4欠損マウスでは細気管支周囲への炎症細胞浸潤が顕著に増加しするのが見て取れる。(B)は、Sox4欠損マウスでは、アレルギー炎症で誘導される気管支からの粘液産生(矢印の濃い紫部分)の亢進が増悪するのを撮影したもの。(C)は、Sox4欠損マウスでは、アレルギー炎症に伴う気道過敏性の亢進が増悪するという結果をまとめたグラフ。
|
|
|
|
画像5。Sox4TGマウスでは、マウスアレルギー性気道炎症モデルの病態が改善するという様子を撮影した顕微鏡画像と結果をまとめたグラフ |
画像6。Sox4ノックアウトマウスでは、マウスアレルギー性気道炎症モデルの病態が増悪するという様子を撮影した顕微鏡画像と結果をまとめたグラフ |
また、研究グループは、Sox4のアレルギー抑制の分子機構についても解析し、Sox4の作用の一部は、Th2細胞の分化とアレルギー疾患発症を制御する転写因子「GATA-3」の機能の抑制を介して発揮されることも見出した(画像7)。
画像7は、研究成果の概略図。Sox4は、TGF-βによって発現が誘導される一方で、その発現はアレルゲン(抗原)刺激によって低下することが、今回の研究から判明した。TGF-βと抗原刺激のバランスによって発現が調節されたSox4は、Th2細胞分化のマスター転写因子GATA-3機能を阻害することで、アレルギーの発症を抑えることが今回の研究で新たにわかったのである。
Sox4の作用を促進した場合でも、Th2細胞の機能のみが阻害され、そのほかのThサブセットの機能には、今のところ顕著な障害は見出されてはいない。また今回の研究成果から、慢性的なアレルゲンの曝露によりTh細胞が持続的な刺激を受け、Sox4の発現が長期間にわたって低下することが、アレルギーの慢性化を引き起こす原因となるといった新たな炎症の慢性化の仮説も提唱できるという。
これらのことから、今後、Sox4やGATA3を創薬ターゲットとして研究を発展させ(画像8)、人為的な発現調節を可能にすることが、新規のアレルギー予防法だけでなく、発症後時間が経過し慢性化してしまった難治性アレルギー疾患の治療法開発につながることが期待されるとしている。