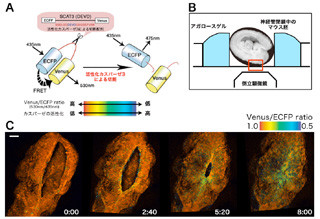
北海道大学(北大)は、「T細胞」活性化後に起こる「アポトーシス(細胞死)」を調節する細胞内タンパク質「STAP-2(Signal-transducing adaptor protein-2)」を同定し、STAP-2がアポトーシスを誘導するタンパク質分解酵素「カスパーゼ8」と直接結合してその働きを強めることにより、アポトーシスを促進するのを確認したと発表した。
成果は、北大大学院薬学研究院の松田正教授らの研究グループによるもの。研究の詳細な内容は、5月18日付けで免疫を扱った米国の雑誌「The Journal of Immunology」に掲載された。
病原体が体内に侵入した場合、免疫担当細胞による複雑なネットワークが活性化されると共に、炎症像を示す感染巣が形成される。侵入抗原特異的に反応したリンパ球は増殖・分化し、Bリンパ球は抗体産生により、Tリンパ球は細胞障害作用により、病原体の除去に働く。
一方、感染が終息した時点で、活性化され増殖したリンパ球はアポトーシスにより消去される(activation-induced cell death)。働きの終わったリンパ球の細胞死はリンパ組織の恒常性維持に必要だ。
そのほかにも、生体の恒常性を維持するためにアポトーシスがしばしば引き起こされる。よって、アポトーシス機構の障害は免疫疾患、がん、神経変性疾患などの発症に関係している形だ。
特に最もよく知られたアポトーシス機構の障害は、アポトーシスを担う受容体分子として同定された三量体の「Fas」タンパク質の異常によるものである。免疫担当細胞の中で活性化T細胞は、細胞表面にFasタンパク質を発現するという特徴を持つ。
これに「活性化B細胞」、あるいはT細胞表面の「Fasリガンド(FasL)」タンパク質が結合することによりアポトーシスシグナルが伝達され、細胞内のタンパク質分解酵素カスパーゼ経路が活性化されて細胞死が誘導されるという仕組みだ。なお、リガンドとは受容体に特異的に結合する物質であり、受容体と高い親和性を有する。Fasリガンドとは、Fasタンパク質にのみ結合するタンパク質というわけである。
それに対し、これらFasやFasLタンパク質や下流に存在するカスパーゼなどのシグナル伝達分子に異常がある場合には、アポトーシスシグナルの伝達が障害され、細胞死が誘導されない。
よって、T細胞やB細胞の細胞死が起こらないため、「自己反応性T細胞」、あるいは「自己抗体産生B細胞」が異常に増殖し、「リンパ節腫」が起こり、「抗DNA抗体」やリウマチ因子などの自己抗体の産生が誘導され、多様な自己免疫疾患が発症することが示されてきたのである。
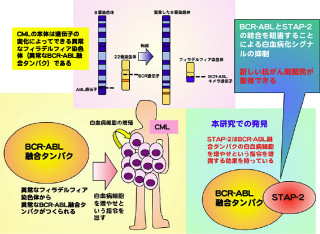
研究グループは細胞内シグナル伝達において、「リン酸化酵素」を始めとする酵素群や転写因子の活性化を制御するアダプター分子の1つである「STAP-2」の働きについて研究してきたが、今回の研究では、STAP-2タンパク質が自己免疫疾患発症を防ぐ活性化T細胞のアポトーシスにおいてどのように働くかが検討された形だ。
ヒトT細胞白血病株「Jurkat」にSTAP-2タンパク質を過剰発現させた場合、Fas誘導性のアポトーシスが著明に増強された。また、STAP-2欠損T細胞では、Fasや抗原刺激による細胞死の抑制が観察された。即ち、T細胞活性化後に誘導される細胞死にはSTAP-2の存在が必要であることが判明したのである。
STAP-2欠損マウスを用いた実験により、生体内で起こる活性化T細胞の除去についても、STAP-2による制御が確認された。STAP-2がどのような形でアポトーシスに関わっているかについては、STAP-2タンパク質はアポトーシスシグナルを担うFasやカスパーゼ8タンパク質と相互作用することが確認されたのである。
以上、STAP-2タンパク質はタンパク質分解酵素であるカスパーゼ8の活性を増強することにより、アポトーシスシグナルを正に調節するタンパク質であることが明らかになったというわけだ。
自己免疫性リンパ増殖症候群(ALPS)などの自己免疫疾患の患者さんのための新しい薬の開発を行う際に、STAP-2タンパク質は重要な標的分子となり得ると考えられ、STAP-2タンパク質を活用したカスパーゼ8の働きの調節メカニズムを解明することにより、自己免疫疾患の新しい薬の開発が期待できると、研究グループはコメントしている。