慶應義塾大学(慶応大)は5月21日、脳梗塞後の炎症反応を引き起こす脳内因子を新たに発見し、この脳内因子の活性を抑えると梗塞領域が縮小し、神経症状が改善することを確認したと発表した。
成果は、同大の七田崇(シチタ・タカシ)助教、同吉村昭彦教授らの研究グループによるもの。研究は、JST課題達成型基礎研究の一環として行われた。研究の詳細な内容は、英国時間5月20日付けで英科学雑誌「Nature Medicine 」オンライン版に掲載。
脳梗塞は、脳の血管が詰まるなどして脳血流が乏しくなること(虚血)によって脳組織が壊死に陥る病態だ。日本では患者総数96万人といわれ、がんに匹敵する患者数だ(厚生労働省「平成20年患者調査」より)。
そして、脳梗塞の死亡者数は年間約7万人(厚生労働省「平成22年人口動態統計」より)で、死亡率が高いだけでなく、助かっても寝たきりになるなど患者の生活の質(QOL)が非常に悪いことが特徴である。
これまでの脳梗塞の治療は発症直後(4.5時間以内)に「血栓溶解薬」を投与するなど、限られた治療法しかなかった。しかし、梗塞後徐々に炎症が起こって脳組織が浮腫を起こして腫れることにより、梗塞領域が広がったり、病状が悪化したりすることがあり、それらを抑制することも重要と考えられている。
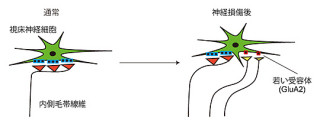
脳組織に炎症が起こると、壊死した組織の中に血液由来の免疫細胞(「マクロファージ」や「リンパ球」)が多数存在し、なおかつ活性化したそれらが炎症性因子を産生することによってさらに炎症が促進されてしまう。その結果、壊死した組織周囲の正常組織を傷つけて梗塞領域を拡大させてしまうというわけだ(画像1)。
特に、マクロファージは発症早期に浸潤し、炎症をスタートさせるカギの細胞となっている。しかし、マクロファージがどのような機構で活性化されるのかはまったく不明だった。
これまでの研究で、マクロファージが細菌を認識するのに使っている「Toll様受容体(Toll-like receptor:TLR)」が、脳梗塞後の炎症には必要だということがわかっている。
なおToll様受容体とは、自然免疫の機能を持つ受容体だ。主に細菌のリポ多糖やリポタンパク質、ウイルス由来のDNAやRNAを認識して細胞内シグナルを伝えることにより、さまざまな免疫応答を引き起こす。組織傷害によって放出されたDAMPsを認識する受容体としても注目されている。
しかし脳は無菌的でクリーンな臓器であり、細菌やウイルスなどの外敵は通常存在しない。従って、TLRに認識される何らかの物質が脳組織の中にもともと存在しており、その物質は脳組織が壊死に陥った時に細胞外にばらまかれて、TLRを介してマクロファージを刺激して活性化させると考えられるのだ。
このような物質は、「ダメージ関連分子パターン(Damage-associated molecular patterns:DAMPs)」と呼ばれている。ただし、これまで脳内のDAMPsは不明で、治療の標的になり得るかどうかもわかっていなかい状況だ。
ダメージ関連分子パターンとは、組織傷害に伴って細胞から放出され、周囲の組織や細胞に危険を知らせるアラームのような役割を担う因子のこと。タンパク質「HMGB1(High mobily group box1)」や「熱ショックタンパク質(Heat shock protein:HSP)」、化粧品や医薬品などでに含まれていて保水効果で知られた「ヒアルロン酸」、「酸化型LDL(Low Density Lipoprotein cholesterol:悪玉コレステロール)」などがDAMPsとして機能することが知られている。
今回、研究グループは脳組織中に存在する新規のDAMPsとして「ペルオキシレドキシン(peroxiredoxin:Prx)」を同定。このPrxが壊死した脳組織の中で放出された結果として浸潤したマクロファージを活性化させ、炎症を引き起こしていることが発見されたのである。
なおペルオキシレドキシンとは、これまでは細胞毒である「過酸化水素(H2O2)」などの活性酸素種を無毒化する抗酸化酵素として、細菌や高等植物の細胞内にも存在することが知られていていた。哺乳動物ではこれまでに、Prx1~Prx6の6種類のPrxファミリータンパク質が同定されている。
実験では、まず脳組織の抽出液を作製し、これを培養したマクロファージと同様な機能を持つ「樹状細胞」に添加。すると、さまざまな「炎症性サイトカイン」(「IL-23」、「IL-1β」、「TNF-α」など)を産生することが判明。
脳抽出液を、タンパク質分解酵素で処理すると活性能力がなくなることから、脳抽出液中の樹状細胞を活性化する物質はタンパク質であることも確かめられた。そこで、脳抽出液をさまざまに分画し最終的に質量分析計を用いた解析によって、「Prxファミリー」タンパク質が樹状細胞を活性化していることが突きとめられたのである(画像2)。
なお、画像2の見方は、(1)脳をすり潰した抽出液を樹状細胞に添加すると炎症性サイトカインの一種であるIL-23が産生される。タンパク質分解酵素で処理した脳抽出液ではIL-23は誘導されない。(2)脳抽出液をショ糖濃度勾配によって分子量で分画すると、15~25kDaの分画にIL-23誘導活性があることがわかった。IL-23誘導活性のある分画を質量分析計で解析し、候補となるタンパク質が同定された。(3)タンパク質「リコンビナント」を作製し、樹状細胞に添加したところPrxファミリータンパク質に強いIL-23誘導活性が認められた。
ちなみにPrxファミリータンパク質は、細菌から哺乳類まで幅広く存在し、通常は細胞内にあって過酸化水素を水に変換する酸化防止酵素だ。従って、虚血などのストレスの際には大量に合成されて、細胞内の過酸化水素を水に変換して細胞を保護する働きがあると考えられていた。
しかし、細胞が壊死するとPrxは細胞の外に放出されてしまう。虚血に陥った脳組織では、壊死した組織の周りにPrxを含む細胞の残骸が集積しており、さらにマクロファージと接触していることも発見された(画像3)。
画像3は、Prxは細胞外に放出されてマクロファージを刺激している様子。発症1日目の梗塞中心における免疫染色像を示す。(左)Prx6を高発現する多量の「debris」(壊死した組織の残骸)が存在する(緑色)。(中)F4/80陽性細胞(マクロファージ)が脳内に浸潤している(赤色)。(右)Prx6を含むdebrisがマクロファージの細胞表面上に共局在している。
これらのことは、虚血ストレスの際に細胞を生存させるために細胞内でPrxが発現されるが、細胞死に至るとPrxは細胞外に放出され、周囲に浸潤したマクロファージを活性化するメカニズムがあるということだ(画像4)。
画像4は、Prxが細胞内外で異なる働きを持つことを表した模式図。Prxは過酸化水素(H2O2)を水(H2O)に代謝する。虚血ストレスによって細胞内の過酸化水素が増えると、Prxが細胞内で発現されて過酸化水素を代謝することにより、細胞を生存させる。しかし細胞が壊死すると、細胞内のPrxは「debris」と共に細胞外に放出されて、脳内に浸潤したマクロファージにTLR2とTLR4を介して作用する(DAMPsとなる)。
実際にPrxが樹状細胞を活性化するメカニズムを調べて見ると、Prxは樹状細胞の表面に存在するTLR2やTLR4を介してマクロファージを活性化させていることが判明した。
Prxの変異体を作製して、樹状細胞を活性化するのに必要な構造も調べられた。すると、Prxファミリータンパク質に共通して存在する構造「α3-helix」がTLR2やTLR4を介してマクロファージを活性化させていることが確認されたのである(画像5)。
次に、細胞外に放出されたPrxの活性を除去するために中和抗体が作製された。この抗体は、試験管内で脳抽出液の樹状細胞活性化能を半分以上抑制できることがわかった。
そのPrx抗体を「一過性脳虚血モデル」マウスに投与したところ、脳組織での炎症性サイトカインが抑えられ、梗塞体積が縮小し、神経症状が著しく改善するのが確かめられたのである(画像6)。
なお、一過性脳虚血モデルとは、脳梗塞の動物モデルのことだ。脳血管を閉塞する方法は多数あるが、今回の研究では、細い塞栓糸を頚動脈から挿入して脳血管(中大脳動脈)に到達させ、閉塞させる手技が用いられた。挿入した塞栓糸を引き抜くことにより、脳血管の閉塞を解除させることができる。そのため「一過性虚血再還流モデル」とも呼ばれる。
画像6は、一過性脳虚血モデルマウスにおけるPrx抗体、HMGB1抗体投与の効果をまとめたもの。脳虚血誘導直後に抗Prx抗体、抗HMGB1抗体、またはその両方を投与して、(a)発症4日目の梗塞体積(染色像はMAP2染色:白い部分が梗塞巣を示す)、(b)発症直後から3日目までの神経症状の推移を示す(:P<0.05、 * *:P<0.001vs対照群)。
|
|
|
|
画像5。Prxは共通して、炎症を誘導するための活性部位を持つ。Prxは、TLR2やTLR4を介して樹状細胞に炎症性サイトカインを産生させるための共通構造(矢印:α3-helixを示す)を持つ |
画像6。一過性脳虚血モデルマウスにおけるPrx抗体、HMGB1抗体投与の効果 |
さまざまな炎症でHMGB1が、DAMPs(ダメージ関連分子パターン)として働くことが報告されている。脳梗塞モデルにおいてもHMGB1の細胞外放出が認められたが、HMGB1はマクロファージが脳組織に浸潤する頃には消失し、炎症を引き起こす原因には直接は関与していないことも確認された。
そして今回の実験では、PrxはHMGB1より遅れて虚血後12時間をピークに細胞外に放出されることにより、脳組織に浸潤したマクロファージを活性化することが判明したのである(画像7)。
画像7は、脳虚血における炎症を引き起こす因子としてのPrxの役割を表した模式図で、脳虚血における炎症の経時変化を示す。発症6時間以内の超急性期には、虚血に陥った脳細胞からHMGB1が放出され、これは脳血液関門の破壊に寄与する形だ。
発症12~24時間以内の急性期にはマクロファージの浸潤が著明になるが、HMGB1の放出は見られなくなる。代わりに、虚血ストレスによって細胞内で発現したPrxが細胞死に伴って細胞外に放出され、浸潤したマクロファージをTLR2やTLR4依存的に活性化し、IL-23やIL-1β、TNFαを産生。IL-23はさらに遅れて脳内に浸潤した免疫細胞の1種であるT細胞(γδT細胞)からIL-17を産生させ、さらなる組織傷害を引き起こすという流れである。
今回の研究により、脳梗塞における新たな炎症メカニズムが判明した。さらに、脳梗塞患者の脳内においても同様に、Prxが細胞外に放出されていることが報告されている。そのためPrxは、脳梗塞における治療開始可能時間の比較的長い治療のターゲットになり得ると考えられ、今回の研究の知見が脳卒中医療に応用されることが期待されると、研究グループはコメントしている。