物質・材料研究機構(NIMS)は5月8日、無機物のナノメートル厚のフレーク状物体「ナノシート」でできた伸縮自在のカプセルを新たに開発し、ドラッグデリバリシステム(DDS)用のカプセルとして抗がん剤などの薬物を収めて放出持続時間を自在に制御し、数倍に延長できることを実証したと発表した。
成果は、NIMS 国際ナノアーキテクトニクス研究拠点 超分子ユニットの吉 慶敏(じ・ちんみん)MANA研究者、メルボルン大学(オーストラリア)のF.カルーソ教授らの研究グループによるもの。研究の詳細な内容は、科学誌「Small」オンライン速報版で掲載の予定。
高齢化社会に直面するに当たり、医療技術の開発は持続的な社会環境を形成するための重要なカギになる。特に、微量でありながら効果の大きい薬物や病理に対して設計された遺伝子を、特定の病理部位に送り込むことの必要性は増していくと考えられている。
これまでの単純な薬物投与では、それらの薬物は体内で吸収・分解されるため、患部以外の部位にも広範囲に分散し、患部に必要量の薬物が到達できるかどうかは制御できるとは限らない。さらに、このような方法では、貴重な薬物や遺伝子の多くが無駄に拡散し、副作用の可能性がある。そればかりか、経済的にも望ましくないのはいうまでもない。
そのため、がんなどの病理部位に薬物を確実に送り込む手法として、DDSの技術開発が期待されている。DDSは、マイクロメートルもしくはナノメートルサイズのカプセルなどの担体に薬物を封入し、病理部位に薬物を運ぶという仕組みだ。
ただし現状では、DDSに用いられる薬物担体としてさまざまなカプセルが開発されてきたが、その多くが望まれるすべての性質を満たしているわけではなかった。よって、それらを満たしたカプセル素材を開発することは、物質・材料科学の医療への重要な貢献になるのである。
DDS用カプセルの構成物質は大きく脂質/ポリマーなどの有機物とシリカなどの無機物に分けられ、どちらも長所と短所を併せ持つ。有機物のカプセルは柔らかくて構造の調節が可能だが、機械的強度に劣るという弱点がある。一方、無機物のカプセルは有機物とは反対に硬くて強靭だが、構造を臨機応変に調節するのが容易ではない。有機物と無機物の両者の利点を生かしたようなカプセル構造を薬物担体として開発することが必要なのである。
今回の研究では、機械的に安定な無機物のカプセルでありながら、構造を自在に制御できるカプセルを開発することを目標とした。そのカプセルは、ナノオーダーの厚さでできたフレーク状物質のシリカナノシートがふんわりと集まってでき上がったものだ。
シリカ(二酸化珪素)は、ガラスなどと同じ素材であり、地球上にふんだんにある無機物質で生体適合性(生体組織や細胞に対して炎症反応・免疫反応・血栓形成反応を起こさない性質、また、生体組織・細胞に対して毒性を持たない性質)も高いのが特徴である。またナノシートとは、化学反応を用いて層一枚ごとに剥離して得られる厚さがナノメートルサイズの極薄のシート状物質のことだ。
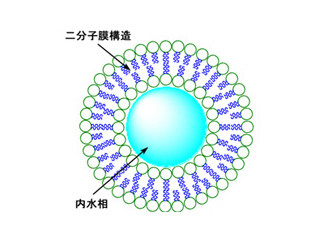
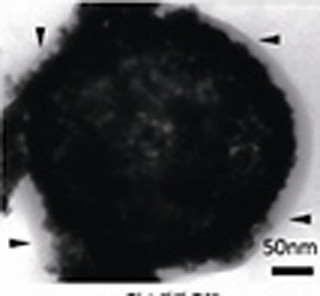
画像1に示すように、シリカ粒子を適当な条件下の溶液中に漬けておくと、ナノ粒子(直径がナノメートルあるいはその10~100倍程度の粒子)が外側から徐々に溶けていきながら、その周囲でナノシートとして再析出する。
最終的に、元のナノ粒子は全部溶けきってしまい、後にはナノシートがふんわり集まってできたカプセルができるというわけだ。ここでできたふわふわのカプセルは「フレークシェルカプセル(コーンフレークのような断片が殻になっている中空カプセル)」と名づけられた。
このカプセルは従来の無機物質のカプセルとは異なり、形状が大変柔らかいという特徴を持っている。例えば、温度をかけながら電子顕微鏡でその形態を観察したところ、直径が20%程度収縮することがわかった。
また、いろいろなpH(溶液中の水素イオンの濃度の指標で、値が7なら中性で、それより小さければ酸性、大きければアルカリ性)の水溶液にさらしておくだけで、カプセル壁の詰まり方(孔構造)を調整することも可能だ。
つまり、こちらの要求に応じていろいろな構造に調整し得るカプセルといえる。無機物の硬い構造を構成要素として持ちつつ、その一方で自在に構造を柔軟に調整できるカプセルは、これまでほとんど例がない。
このカプセルの内部にはさまざまな薬物を取り込むことが可能だ。このカプセル壁はナノシートが入り組んでできているため、その隙間の構造は複雑化している。カプセル内部に取り込まれた薬物はこの隙間を通って外部に放出されるが、この構造を制御することにより、薬物の導入量や放出速度を調節できるというわけだ。
この特性は、薬物を持続的に患部に投与するというDDS機能にとって大変重要なものである。抗がん剤「DOX」(ドキソルビシン(慣用名:アドリアマイシン)のことで、現在最も臨床で使われている抗がん剤の1つ)を用いた研究グループの実験では、従来の単純構造のメソポーラスカプセルに比べて、今回のフレークシェルカプセルでは数倍も薬物放出持続時間が長いことが確かめられた。
画像2は、構造がコントロールできるフレークシェルカプセルと、孔の大きさが固定されている従来のシリカカプセル(ポーラスカプセルあるいは多孔性カプセル)を比べたものだ。
グラフの取り込み量はカプセルを分散した水溶液にDOXが取り込まれる割合で、放出量はそのうちの何%が4時間後までに放出されたかを示す。フレークシェルカプセルは取り込み量が多く、放出速度が遅いので、薬物放出の持続時間(薬物が患部に送られ続ける時間)が極めて長くなる。
ちなみに、従来のカプセルが20%程度しか溶液中のDOXを内部に取り込めない条件で、フレークシェルカプセルは90%以上のDOXを内部に取り込むことができる。これはフレークシェルカプセルの方がより孔が開いていたり、水溶液との接触面積が大きかったりすることで、その内部にDOXを容易に取り込むからだ。
この後、フレークシェルカプセルを処理して孔を小さくしたところ、普通のポーラスカプセルでは4時間後に80%以上のDOXが漏れきってしまうのに対し、フレークシェルカプセルでは10%以下の放出率に抑えることができることも判明した。抗がん剤DOXの取り込みや易さと放出しにくさをカプセル構造のコントロールで制御したわけだ。
この効果により、フレークシェルカプセルにはより多くの抗がん剤を封入できると同時に、その放出速度を抑えることができた。結果として、従来のポーラスカプセルに比べて、抗がん剤放出持続時間が格段に長くなり、1つのフレークシェルカプセルで数日間、持続的に抗がん剤を投与することも可能となったのである。
また、カプセルをあらかじめ適当なpH条件下で処理しておくと、薬物を通す孔の構造が変わり、薬物の放出持続時間や薬物の貯蔵量を微調整することも可能だ。
病理部位に薬物を投与するために必要な条件は、病理や薬物によって千差万別であり、それぞれに最適なDDS系を開発することは、経済的にも労力・時間的にも必ずしも容易なことではない。だから、1つの物質系から多様に展開できることには大きなメリットがあるというわけだ。
今回開発した無機物のフレークシェルカプセルでは、元の粒子の選択や後処理によってカプセルの大きさが調節可能であり、薬物を通過させる孔構造もpH変化による処理などによって簡単に変えられるという特徴を持つ。
結果として、望みの量の薬剤を内部に封入し、かつ、それを望みの速度で持続的に放出することができる。従って、さまざまな病気の状態に合わせ、量や持続時間を自在に調節できる優れた薬物運搬体になり得るというわけだ。
また、将来的な展開として、シリカ外壁をさまざまな化学物質や生体物質で修飾することも可能だという。例えば、表面に特定の標的を認識できる抗体を結合させれば、特定の病的部位にのみ薬物を送り込む「ミサイル療法」も可能になるというわけだ。
このように構造を自在に調節できるカプセルの開発・提案は、DDS素材の開発に新たな指針を与えるものになるだろうと、研究グループはコメントしている。