理化学研究所(理研)は、細胞の核と細胞質間でタンパク質などを輸送する新しい運搬体分子「Hikeshi(火消し)」を発見し、細胞が環境ストレスを受けると、正常時とはまったく異なる輸送システムが働くことを見出したと発表した。
成果は、理研基幹研究所今本細胞核機能研究室の小瀬真吾専任研究員と今本尚子主任研究員らの研究グループによるもの。研究の詳細な内容は、米科学雑誌「Cell」4月27日号に掲載された。
酵母やカビなどの細菌やヒトを含む動植物は、「真核生物」と呼ばれ「真核細胞」で成り立っている。真核細胞は、転写やDNA複製などの遺伝子機能の場である核と、タンパク質合成の場である細胞質で構成され、これらは2層の脂質膜からなる「核膜」で隔てられている。
核と「細胞質」の間では分子が絶え間なく往来しており、細胞の生命活動の基礎を成している形だ。この過程が、核膜に存在する「核膜孔複合体」を介した「核-細胞質間輸送」である。
核膜孔複合体とは、核膜に存在する孔を構成する総重量125メガダルトン(12Da=静止して基底状態にある炭素原子12Cを1個分)の巨大なタンパク質複合体だ。核と細胞質を往来するすべての物質の通り道となっている。通り道は疎水環境と考えられており、核膜孔複合体を通過する分子は疎水性の性質を持つ。
そして核-細胞質間輸送とは、核膜で仕切られた細胞質と核の間の選択的物質輸送のことである。タンパク質やRNAのほかに、リボソームやウイルス粒子が輸送の対象だ。細胞質から核への輸送(核内輸送)や核から細胞質への輸送(核外輸送)があり、いずれも核膜に存在する核膜孔複合体を通して行われる。
核膜孔複合体を自由に行き来できない分子は、一般に核膜孔複合体通過能を持つ「運搬体分子」に結合して運ばれる。運搬体分子はある場所で輸送対象と結合し、運び込む目的の場所でその対象を解離するので、濃度勾配に逆らった物質輸送が可能だ。
核-細胞質間輸送の運搬体分子が初めて発見されたのは1995年のことで、それが「importinβ(インポーチンベータ)」である。importinβは、低分子量タンパク質「GTPase」である「Ran」(GTP(グアノシン三リン酸)との結合でオン、GDP(グアノシン二リン酸)との結合でオフの機能をはたす分子スイッチ)の作用で、運搬体と基質の結合解離が調節されているのが特徴だ。
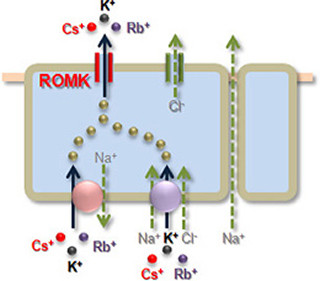
importinβは今日までに類縁が見つかり、そのファミリ分子の存在とそれらが担う輸送の仕組みが明らかにされてきた(画像1)。
画像1は、運搬体分子群importinβファミリによる輸送の基本メカニズムで、正常時に機能する運搬体分子群importinβファミリによる輸送の仕組み。importinβファミリには、細胞質から核に輸送する核内輸送運搬体(importin)と、核から細胞質に輸送する核外輸送運搬体(exportin)がある。
現在では、importinβファミリと総称される運搬体分子群が、正常時の細胞内で発現するタンパク質の核-細胞質間輸送の大部分を担うと考えられ、酵母からヒトまで進化的に保存された因子としても知られている。
一方、細胞が飢餓、酸化、熱などの環境ストレスを受けると、ストレス時特有の反応が作動し、例えば、正常時に働く転写や翻訳は遮断される仕組みだ。この時の細胞内では、importinβファミリは効率よく機能しない。
ちなみに環境ストレスとは、生物が自然界から受けるストレスのことである。細胞の場合、栄養不足、酸化ストレス、重金属、熱ストレス(温度変化)などがあり、生命活動に悪影響を与えるストレスは多様だ。今回の研究では、細胞が受けるストレスの優れたモデルケースとして熱ストレスを利用した(熱ストレスは、温度変化で速やかにストレス応答を誘引し、正常温度に戻すと速やかにストレスが解除されるという、切れのよい可逆性を持つ)。
また、変性したタンパク質の立体構造形成を助ける「分子シャペロン」が動員され、細胞をストレスダメージから守るという巧妙な仕組みが働く。分子シャペロンとは、多様なタンパク質の適切な立体構造形成を助けるタンパク質の総称だ。合成途中の不安定な新生ポリペプチド鎖や熱などで変性したタンパク質が凝集することを防ぐと共に、タンパク質の膜通過、品質管理、分解などさまざまな場面で介添えタンパク質として機能する。
代表的な分子シャペロンの1つであり、熱ショックタンパク質の「Hsp(Heat Shock Protein)70」(分子量が70キロダルトンであることからそう呼ばれる)は、1970年代に、個体や細胞を熱などの環境ストレスにさらすと発現上昇するタンパク質として発見された。しかし、1980年代半ばになると分子シャペロンとして機能することもわかり、ミトコンドリアや小胞体などの細胞内輸送に関与することが明らかにされてきた。
そして、熱ストレス時に効率よく核に移入することが知られていたが、その生理的重要性やその仕組みはわかっていなかったのである。
そこで研究グループは、ヒトの生きた培養細胞の熱ストレス時に見られる核-細胞質間輸送反応を試験管内で再構築し、分子シャペロンHsp70を細胞質から核に運ぶ活性を調べた。すると、新しい運搬体分子が発見されたのである。
この運搬体分子は、酵母からヒトまで進化的に保存されたタンパク質だが、importinβファミリに属さない新しい構造を持っていた。研究グループは、この運搬体分子がストレス時に示す細胞機能から、「Hikeshi」と名付けたというわけだ。
細胞が環境ストレスを受けると、異常タンパク質が生まれてしまう。そこで分子シャペロンHsp70は、この異常になったタンパク質の機能を回復させるため、細胞内では「ATP(アデノシン三リン酸)結合型」と「ADP(アデノシン二リン酸)結合型」に変換される(Hsp70のATPaseサイクル)。
Hsp70のATPaseサイクルには、シャペロンを補助する「Hsp40」や「Hsp110」などの「コシャペロン」の作用が必要だ。Hikeshiが働く仕組みを調べるために、輸送を再構築して解析された。その結果、HikeshiはHsp110などによりATP型に変換されたHsp70に結合し、細胞質から核にHsp70を運ぶことを突き止めたのである。
一方、Hsp40によりADP型に変換されたHsp70から解離することも判明した(画像2)。なお、Hsp110はADP型Hsp70をATP型に変換するコシャペロンで、Hsp40はATP型Hsp70をADP型に変換するコシャペロンだ。Hsp70はコシャペロンの作用でATP型とADP型に変換しながら、立体構造を失った異常タンパク質を正しく折りたたんで(立体構造を持たせる)機能を回復させるのである。
これらのことから、分子シャペロンのシステムがHikeshiとHsp70の結合と解離を制御するまったく新しい輸送システムモデルを提示したというわけだ(画像3)。
画像3は、Hikeshi輸送経路のモデルである。細胞のストレス時に、細胞質のHsp70はHsp110などのコシャペロンの作用でATP型に変換されると、Hikeshiに結合する。Hikeshiに結合したATP型Hsp70は核膜孔複合体を通過して核の中に移入する。核の中で、Hsp70はHsp40など別のコシャペロンの作用でADP型に変換されると、Hikeshiから解離する仕組みだ。
ADP型Hsp70は、変性タンパク質の立体構造を再構築し、核タンパク質と相互作用してその機能を制御する。Hikeshiで核に運ばれたHsp70などの分子シャペロンの働きによって、ストレスで誘引される核内構造や機能ダメージが修復される形だ。その結果、細胞はストレス状態から回復して生存できるのである。
なお、画像中の「HSF」とはHeat Shock Factorの略で、ストレスに応答して活性化される転写因子のことだ。熱ストレスでHsp70の転写をonにすることで同定されたが、ターゲット遺伝子はHsp70のほかにも多く知られており、また、熱ストレス以外のストレスでも機能する。
次に、Hikeshiを除去したヒトの培養細胞を作製し、その影響が調べられた。その結果、ストレスを受けた細胞は生存できなくなることが判明したのである(画像4)。
画像4を補足すると、正常細胞の画像はストレス要因が除去されると細胞はストレスから回復して生存し、増殖するのをとらえたものだ。そしてHikeshi除去細胞は、Hsp70の核への移入が阻害されるため、ストレス要因を除去しても細胞はストレスから回復できずに死んでしまう。
通常、ストレスを受けた細胞はダメージを受けるが、ストレス要因が除かれるとそのダメージが速やかに修復されてストレス状態から回復する。しかし、Hikeshiを除去した細胞では、ストレス要因が除かれてもダメージが修復されず、ストレス状態から回復しなかった。
その原因の1つは、ストレス時に核に輸送されるはずのHsp70の働きが阻害されたことが理由である。Hikeshiは細胞のストレス状態を鎮めるために必要で、その名はまさに火事の火消しのような働きをすることに由来しているのだ。
分子シャペロンの機能は老化や発生、またはがんや神経疾患と密接な関係がある。今回、細胞がストレスダメージを修復してストレス状態から回復するために、分子シャペロンの核内機能が重要であることを、Hikeshiの発見によって初めて実証することができた。
また、ストレス時に駆動するHikeshi輸送経路の活性化には、分子シャペロンのシステム全体が寄与すると考えられる。これまで、importinβファミリーで担われる輸送のメカニズムの重要な部分は明らかにされていると考えられていたが、何が要因でその輸送効率が低下するのかはわかっていない。その要因を明らかにすることは、「輸送の制御」という概念に一石を投じることになる。
ストレス時に正常時の輸送がどのように低下し、また実際にストレス時にHikeshiで担われる輸送がどのように細胞内で分子シャペロンシステムと組み合わせて働くのかを明らかにすることが、これからの課題であると、研究グループはコメント。今後、この細胞機能がどのような仕組みで生体の高次機能に影響を及ぼすのかを明らかにすることを目指すとしている。