慶應義塾大学(慶大)は、「蛍光」と「発光」のそれぞれの利点を併せ持つバイオイメージング技術を開発したと発表した。成果は、慶應義塾大学医学部生理学教室の岡野栄之教授、理化学研究所脳科学総合研究センターの宮脇敦史グループディレクター、東京医科歯科大学大学院保健衛生学研究科の原央子助教らの共同研究グループによるもので、「Biochemical and Biophysical Research Communications」電子版に掲載された。
実験動物の内部で、細胞や分子の活動を直接観察する試みが、近年活発に行われるようになってきた。がん細胞の浸潤転移や、移植した細胞の移動や増殖、そして細胞の薬剤への応答を、実験動物の体の奥深くで非侵襲的に観察できれば、より効率よく治療法や薬剤の開発に結びつけることができるからだ。
「遺伝子導入による標識法」(機能タンパク質の遺伝子に蛍光タンパク質、または発光タンパク質の遺伝子を連結させておき、蛍光タンパク質を観察することにより機能タンパク質の局在を知る方法)として、「蛍光タンパク質」と「発光タンパク質」が使われている。
一方で、細胞や実験動物の組織において、タンパク質の分布や局在を画像化して捉え、挙動を追跡する技術である「バイオイメージング」は、未だ改善の余地がある状況だ。
下村侑博士が発見して、2008年にノーベル化学賞を受賞した「GFP(緑色蛍光タンパク質)」は、代表的な蛍光タンパク質であり、青色光を吸収して緑色蛍光を発する仕組みを持つ。研究グループの宮脇グループディレクターらも、明るい改良型GFP(「ビーナス」と命名)の開発を2002年に発表しており、GFPやビーナスは現在のバイオイメージングの必要不可欠なツールとなっている。
ところが、マウスなどの小さな実験動物であっても、体内奥深くの蛍光タンパク質のシグナルを体外で観察することは困難だ。蛍光を起こす(発する)のに必要な励起光(れいきこう)を体内深部まで届かせることが難しいことが理由である。
対して、ホタルの「ルシフェラーゼ」といった生体分子の「発光タンパク質」は、励起光源を必要とせず、発光基質「ルシフェリン」(酵素であるルシフェラーゼによって発光の化学反応が進行する)と「アデノシン三リン酸(ATP)」(ヒトはもちろん、生物の生体内で用いられるエネルギー減)を基質とする化学反応を施行することで、自ら光子(フォトン)を作り出すことが可能だ。すなわち、励起光が届かない体内の深部においても、光を発することができるのである。
しかし従来の発光タンパク質は、発生する光子の数が少ないことが問題点だった。例えば、培養細胞の観察においても、蛍光タンパク質を使えば毎秒33枚以上の高速画像取得が可能なのに対して、発光タンパク質を使う場合には一画像を取得するのに露光時間が数分以上必要であることが一般的だったのである。
発光タンパク質が発光に必要とするのは、基質であるルシフェリンと、エネルギー供給源となるATPだ。発光に必要なルシフェリンは、体内を隈無く循環させることが可能であり、ATPは生物の細胞内に高濃度で存在している。よって、酵素活性の高いルシフェラーゼを開発すれば、生体内の奥深くにおいても多量の光子生成が可能であり、より高感度なバイオイメージングが実現できるという算段だ。
研究グループが目指したのは、「実用的に明るい」発光タンパク質である。研究グループでは、前述した蛍光タンパク質のビーナスの高い「フォールディング効率」(ここでは、遺伝子から転写翻訳された蛍光タンパク質が、本来の形を形成し、蛍光タンパク質として機能する状態になる効率のこと)に注目し、ビーナスとの融合タンパク質にしたルシフェラーゼが、従来単独型より優れた安定性および化学反応活性を持つと予想して、画像1に示す「蛍光タンパク質融合ルシフェラーゼ(fluorescent protein fused Luciferase:ffLuc、フォルティシモ・ルシフェラーゼ)」を作製した。
さまざまな培養細胞に導入したところ、ffLucは予想を遙かに上回る発光強度を示したのである。続けて、ビーナス部分も改変型にするなどの改良を施し、発光強度をさらに向上させた「ffLuc-cp156」が開発された。
ffLuc-cp156を発現する培養細胞からは、従来型ルシフェラーゼを発現させた細胞に比べて数倍から数百倍強い発光が得られた形だ。従って、長時間にわたる培養細胞の微細構造の変化を、従来の数十倍の時間分解能で観察することができるというわけだ。
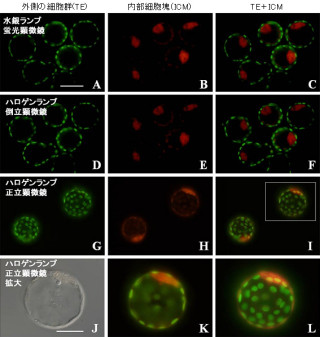
ビーナス改変体を含むffLuc-cp156は、励起光を照射することによって検出することが可能である。従って、ffLuc-cp156を発現する細胞を見出したり、焦点を合わせたりする際は、こうした蛍光モードを利用することができる。マウス体内においても、近接的な観察の場合には、ビーナスの蛍光シグナルがより細かく迅速な画像取得を可能にするというわけだ。
培養細胞を観察するには、蛍光タンパク質が広く利用されている。一方、発光観察には、光(励起光)照射による傷害がないという利点があるが、従来の発光タンパク質を利用した観察では、最新の高感度CCDカメラを使っても、一枚の画像取得に数分の露光時間が必要だった。動きの活発な細胞の観察に使える発光タンパク質が求められていたのである。
ffLuc-cp156を用いる発光イメージングでは、1秒以下の露光で詳細な観察が可能だ。500msで発光シグナルの撮影ができ、30秒間露光すれば神経細胞の微少な構造を観察することも可能となる(画像2)。ffLuc-cp156の開発によって、光照射による傷害の心配がない長期間観察が実現したというわけだ。
研究グループは、覚醒マウスの個体でffLuc-cp156が生理機能や代謝を研究するツールとして利用できることを示した。すなわち、マウスの全身の細胞にffLuc-cp156を発現させ、さまざまな方法で発光基質ルシフェリン投与を行い、マウス体内でルシフェリン消費が起こる時間的空間的パターンを解析したのである。
例えば、餌のゼリーにルシフェリンを混合させて行った実験においては、マウスが自発的に餌を食べた2、3分後から腹部がオレンジ色の発光を呈すのを観察した(画像3)。
腹腔内にルシフェリンを投与したマウスからのffLuc-cp156の発光は、家庭用デジタルカメラを使っても容易に撮影可能(画像4)。従来の発光観察に使用していた高価な装置がなくても、ffLuc-cp156を利用すれば発光観察を組み入れた研究ができるというわけだ。
|
|
|
|
画像3。ffLucマウスの給餌発光観察。赤:発光シグナル(餌に含まれるルシフェリンが浸透した腹部の細胞から発光が観察された)。緑:蛍光シグナル(マウス全身にffLuc が発現しているので、全身の細胞から緑色蛍光を発する) |
画像4。家庭用デジタルカメラで撮影したffLuc発光マウス |
研究グループでは、ffLuc-cp156の脊髄損傷治療研究への応用も行っている。脊髄損傷モデルマウスへ移植する細胞にあらかじめffLuc-cp156の遺伝子を導入しておき、移植後に脊髄の発光を継続的に観察するという流れだ。ffLuc-cp156の発光には、ルシフェリンのほかにATPが必要であるため、生着した細胞のみが発光することになる。ビーナス蛍光観察と組み合わせて、少数の移植細胞であっても生着の有無(移植細胞の生死)を判定できるようになっているというわけである。
ffLuc-cp156はがん研究においても有用なツールだ。現在、がん細胞をマウス個体内の初期段階において体外から可視化することに既に成功している。ffLuc-cp156を用いて体外からがん細胞を観察すると、外科的に切開しても肉眼では観察できないほど微小な転移性がん組織(転移巣)も、体外から検出できるようになったのだ。また体外から観察できるために、手術や薬剤投与などの治療後の経過観察も容易である。
いずれの場合も、マウスに麻酔をする必要がないため、マウスのさまざまな自発的活動において、発光シグナルを観察し検討することが可能だ。より生理的に自然な条件下で、上記研究が進展することが期待されると、研究グループでは述べている。