科学技術振興機構(JST)、北陸先端科学技術大学院大学(JAIST)、石川県立大学で構成される研究グループは、植物の気孔の数を増やすペプチドホルモン「ストマジェン」の立体構造を解明したことを発表した。これにより、光合成に必要な二酸化炭素(CO2)の取り込み能力を向上させることが可能になる。研究は北陸先端科学技術大学院大学の大木進野教授と石川県立大学の森正之准教授らによるもので、成果は英国時間10月25日に英科学誌「Nature Communications」で公開された。
分子生物学や生化学、構造生物学などの研究現場では、一般的に遺伝子組み換え大腸菌や酵母などを利用して、試料タンパク質を調製する。しかしこの方法では、リン酸化や糖鎖付加などの翻訳後修飾が施されたものや、「ジスルフィド結合」(2個のチオール基(-SH)がカップリングしてできる結合)を持つものなど、調整が困難なタンパク質が存在する。
一方、植物細胞を利用した方法では、大腸菌などの既存方法では調整できないタンパク質を発現できる可能性が指摘されていた。しかし、タンパク質の構造解析を「MNR法」で行うためには、さらに「安定同位体」で標識された特殊な試料を調製する必要があるが、植物細胞を用いて安定同位体標識されたタンパク質を調製したという報告は、これまでなされていなかったのである。
今回の研究では、目的タンパク質の遺伝子を持つ「ウイルスベクター」(細胞に遺伝物質を注入するために用いられる運び屋DNAのうち、ウイルスを作り出す設計図に相当するもの)を植物細胞に取り込ませる方法により、従来法では難しかったタンパク質の安定同位体標識試料を作製した。これまでに、安定同位体である13Cや15Nで均一に標識されたタンパク質を調製する技術を確立。現在は、アミノ酸やある特定の部位を特異的に標識したり、水素を重水素に置換したりするなど、より高度な安定同位体標識技術の確立に取り組んでいる最中である。
今回の新しいタンパク質調整法では、目的タンパク質のもととなる遺伝子を持つウイルスベクターを植物細胞に取り込ませて、タンパク質を発現させる。この方法で用いるのは、液体培地で大量に培養可能で光合成能力がない「タバコBY-2細胞」と呼ばれる日本発の植物細胞だ。
この方法では、従来法で発現させると生理活性を失ったり、そもそも発現させることができなかったりしたタンパク質を、生理活性を保ったまま大量に発現させることが可能である。また、タンパク質に含まれる特定の原子を各種の安定同位体で標識することも可能だ。
こうして調製されたタンパク質についてMNRデータを測定し、その結果を解析することで、タンパク質が本来持っている構造の特徴や、標的となる分子と結合する際に生じる構造の変化や揺らぎなどを、原子レベルで知ることが可能だ。
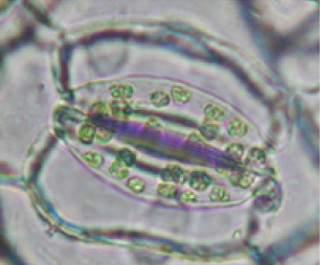
今回、立体構造が判明したストマジェンは、45個のアミノ酸からなるペプチドホルモンだ(画像1)。ストマジェン分子内には3組のジスルフィド結合があることから、遺伝子組み換え大腸菌などの従来技術で調製することは困難である。なお、ペプチドホルモンとはアミノ酸が連なった化合物を指す。アミノ酸の数が多ければタンパク質、比較的少数の場合はペプチドと呼ばれ、ペプチドホルモンはホルモン(生理活性物質)の働きをするペプチドのことだ。
そこで、今回のタンパク質調整法を用いて安定同位体標識ストマジェンを作製したことで、溶液中の立体構造をMNRで解明することに成功したという次第だ。
具体的には、まず植物の仕組みを調べるモデルとしてよく使われる「シロイヌナズナ」のストマジェン遺伝子を、タバコBY-2細胞に導入することからスタート。この細胞を培養し、安定同位体である13Cや15Nで均一に標識されたストマジェンを調製し、これを試料としてMNR測定を行い、得られたデータを解析してストマジェンの立体構造を解析したというわけだ(画像2)。植物のペプチドホルモンの立体構造を明らかにしたのは、世界で初めてのことである。
|
|
|
画像2。ストマジェンの立体構造。溶液NMRで決定したストマジェンの立体構造を模式図(リボンモデル)で表示した。3組のジスルフィド結合は黄色で、αへリックス部位は赤で、βストランド部位は水色で表示した。図中の数字はアミノ酸残基番号を示す。残基番号24から39のループ部分に、気孔の数を増やす働きがあることが判明した |
ストマジェンは、「βストランド」と呼ばれる構造体が3組あるジスルフィド結合で支えられてできている土台部分と、そこから伸びたループ部分からなる独特の3次元構造を持つ。また、ストマジェンと類縁タンパク質が気孔の数を増減する作用は、それぞれのループ部分にあることも確認された。
実際の実験では、気孔の数を減らす働きをするストマジェン類縁ペプチドの土台部分に、ストマジェンのループ部分をつなぎ合わせると、気孔の数を増やす作用をする結果となっている(画像3)。また、ストマジェンのループ部分をほかのペプチドのものに置き換えた変異体は、気孔の数を減らす働きをした(画像4)。
今回の成果により、植物の気孔の数を制御する物質の設計が可能となったことから、将来的には植物の気孔の数を調節することで、植物が光合成する際の効率を調節できるようになる可能性が開けた形だ。さらに、植物の成長速度を調節し、CO2削減や食料生産性向上などを目的とする、環境に優しいペプチド農薬の開発も期待される。さらに、従来の技術では限界だったために研究が進んでいなかったタンパク質の解析も可能となり、同時に大規模化も容易なため、ペプチド農薬の大量生産や新薬開発などの産業応用にも適用できると研究グループでは説明している。