京都大学 大学院医研究科の岩田想教授、島村達郎特定講師、小林拓也講師らは、九州大学の白石充典助教および米国・スクリプス研究所のレイモンド・スティーブンス教授との共同研究として、花粉症の薬の標的である「ヒスタミンH1受容体(H1R)」の立体構造をX線結晶構造解析によって解明したことを発表した。同成果は、英国科学雑誌「Nature」(オンライン速報版)で公開された。
花粉症をはじめとするアレルギー疾患は、花粉などの異物に免疫機能が過剰に反応することが原因。アレルギー症状が起こるメカニズムは複雑だが、花粉症やアレルギー症状は、花粉などの刺激で体内にあるヒスタミンなどの炎症物質が飛び出し、それらが神経や血管細胞にあるヒスタミン受容体と呼ばれる膜たんぱく質(Gたんぱく質共役型受容体:GPCR)に結合することで引き起こされる。
花粉症薬などで知られる抗ヒスタミン薬は、ヒスタミンが受容体H1Rに結合するのをブロックすることで花粉症などのアレルギー症状を抑制するが、抗ヒスタミン薬は、H1R以外の受容体にも結合しやすいため、眠気や口渇、不整脈などの副作用を引き起こす場合がある。このような副作用は、抗ヒスタミン薬が脳に移行しやすいことや、H1R以外のアミン受容体にも結合しやすいことなどが原因であり、より選択性が高く、強い効果を持つ抗ヒスタミン薬を開発するためには、H1Rの立体構造を明らかにする必要があった。
その一方、膜たんぱく質であるH1Rは、可溶性の細胞内のたんぱく質と異なり、立体構造を明らかにするために必要なたんぱく質の精製や結晶化が困難なため、これまで立体構造が解明されておらず、今回、研究グループでは、より副作用の少ない抗ヒスタミン薬の探索・設計のために必要なH1Rの構造情報を得ることを目的に、H1Rの立体構造の解明を行った。
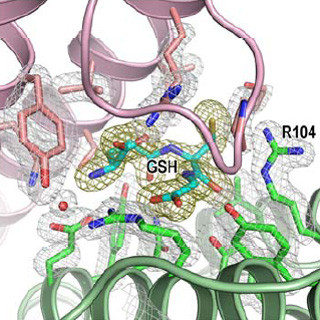
研究の内容としては、まず、人が持つH1R遺伝子を合成し、酵母を用いてH1Rを大量に発現・精製するための技術を構築した。H1Rは、膜たんぱく質の結晶化で効果をあげているLipidic cubic phase法を用いて結晶化を行い、X線結晶構造解析によって抗ヒスタミン剤の一種であるドキセピンとH1Rの複合体の立体構造の解明を行った。
その結果、H1Rの全体構造は、これまでに構造が決定されているGPCRと同様に7本の膜貫通したらせん構造のヘリックスを持ち、H1Rとともにアミン受容体ファミリに属すβ2アドレナリン受容体やドーパミンD3受容体とよく似た構造であることが確認された。
|
|
|
図1 H1Rとドキセピン複合体の立体構造 |
ドキセピンは、H1R以外のアミン受容体でも保存されているアミノ酸に囲まれており、このことは、ドキセピンが他のアミン受容体にもよく結合する原因の1つであることを示している。また、ドキセピンが結合している部位の近くに、H1R特有のアミノ酸と相互作用しているリン酸イオンの結合も確認された。
|
|
|
図2 リガンド結合部位の様子 |
研究グループではさらにH1Rの立体構造情報を利用して、抗ヒスタミン薬の中で第2世代と呼ばれ、H1Rへの結合選択性が高いレボセチリジンやフェキソフェナジンとH1Rの複合体構造を、コンピュータを用いて計算した。
|
|
|
図3 H1RとH1R選択性の高い薬剤との結合モデル |
その計算結果から得られたモデルでは、これらの薬剤のカルボキシル基が上述のリン酸イオンと同等の位置に存在し、H1R特有のアミノ酸と相互作用していることが確認されたことから、レボセチリジンやフェキソフェナジンのH1Rへの結合選択性の高さは、H1Rに特有のアミノ酸とカルボキシル基との相互作用が原因であることが示唆され、抗ヒスタミン薬のH1Rへの結合選択性は、H1R特有のアミノ酸との相互作用が重要な役割を担うことが示されたという。
創薬分野では近年、たんぱく質の立体構造をもとにした創薬戦略(Structure-Based Drug Design)が進められており、中でも人が持つ受容体が創薬のターゲットとして注目を集めており、これらの受容体の立体構造を明らかにすることで、より効果的な薬剤の設計が可能になると期待される。
H1Rの立体構造が明らかとなった今回の成果により、抗ヒスタミン薬の結合部位の詳細情報を得ることができたことから、これらの情報をもとに、今後、副作用を抑えた抗ヒスタミン薬の探索・設計が可能になると考えられ、将来的には、従来以上に効果を発揮しつつ、人体への負担が少ない花粉症やアレルギー症の治療薬が開発される可能性が出てきたこととなる。