東北大学は6月15日、失明に繋がる網膜疾患の病態の一部をチップ上で再現することに成功したと発表した。
同成果は、東北大学大学院工学研究科 梶弘和准教授、同医学系研究科 阿部俊明教授らの研究グループによるもので、6月14日付けの英国科学誌「Scientific Reports」に掲載された。
加齢黄斑変性など新生血管の出現は失明原因の主要な病態として重要だが、加齢、酸素濃度、エネルギー代謝、圧、血流、遺伝子などさまざまな因子が関わっており、その背景は複雑である。新しい薬剤や治療法の開発には、眼疾患の病態メカニズムを正確に理解することが必須であり、複雑で慢性的な病態を簡単に模擬できる培養モデルが有用となる。最近、創薬を目的とした生体組織チップの開発が盛んに行われているが、肺や肝臓、腸などを対象としたものがほとんどで、眼を対象とした研究はほとんど行われていなかった。
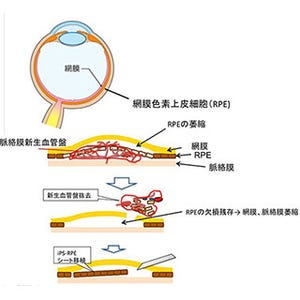
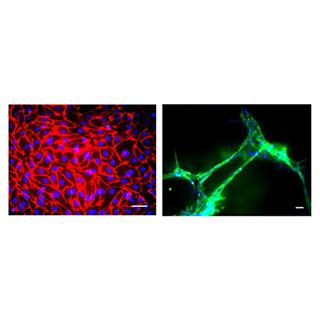
今回、同研究グループは、眼底構造を模倣してヒト由来の網膜色素上皮(RPE)細胞と血管内皮細胞を3次元マイクロ流路デバイス内に配置・培養して、細胞周囲環境を制御下で両細胞間の相互作用を検討。この結果、細胞がある程度成長した後に、RPEを低血糖状態や低酸素状態にすると、血管内皮細胞がRPE側に移動し、RPEがダメージを受けることがわかった。
この過程は、滲出型加齢黄斑変性の主要な病態である新生血管の発生を一部再現したものであることから、同研究グループは、疾患モデル動物の代替として病態解析や創薬スクリーニングに応用できる可能性があると説明している。