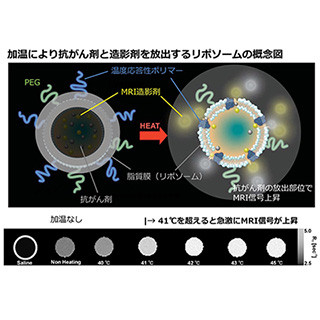
金沢大学は5月31日、原子間力顕微鏡を用いて、大腸がん細胞の核の表面に存在する核膜孔の可視化、および抗がん剤として期待される薬剤による核膜孔の変化をビデオ撮影することに成功したと発表した。
同成果は、金沢大学新学術創成研究機構革新的統合バイオ研究コアセルバイオノミクスユニットおよび理工研究域バイオAFM先端研究センター分子・細胞部門 リチャード・ウォング教授らの研究グループによるもので、5月22日付けの米国科学誌「ACS Nano」オンライン版に掲載された。
核膜孔は細胞の核を覆う膜にある穴で、細胞質と核のあいだの物質輸送における唯一の通り道となっている。脊椎動物の核膜孔は核膜孔複合体(NPC)と呼ばれる約120MDaの巨大タンパク質複合体であり、直径120nmの筒状チャネルであると考えられているが、これまで核膜孔が動いている様子を観察した事例は報告されていなかった。
今回、同研究グループは、ヒト大腸がん細胞から核膜を生きたまま取り出し、同大学がこれまでに開発した高速原子間力顕微鏡(High-Speed Atomic Force Microscopy:HS-AFM)で核膜孔を観察。この結果、これまで観察することができなかった核膜孔を構成するNPCタンパク質のダイナミクス撮影に成功した。
さらに、現在再発癌臨床試験で使用されているアポトーシスおよびオートファジー誘導物質であるAlisertib(MLN8237)を使用した際にがん細胞の核膜孔がどのように変化するのかをHS-AFMで観察したところ、ヌクレオポリンの機能低下が起こり、フェニルアラニン-グリシン-ヌクレオポリンの核膜孔ゲートが変形、喪失し、がん細胞が死んでいくことを見出した。
同研究グループは、同核膜孔ゲートの変形と喪失が、がん細胞が死に至るコードのひとつであると結論付けており、今回の研究で得られた知見は今後、核を標的としたナノドラッグデリバリーシステムの開発に活用されることが期待されるとしている。