東京大学(東大)は3月29日、B細胞性急性リンパ性白血病(B-ALL)の原因となる新たながん遺伝子を解明したと発表した。
同成果は、同大学大学院 医学系研究科 間野博行教授らの研究グループによるもので、3月28日付けの英国科学誌「Nature Genetics」オンライン版に掲載された。
B-ALLは、15才から39才までの思春期-若年成人(AYA)世代に最も多いがんのひとつで、その9割以上においてがん遺伝子・発がん機構がわかっておらず、有効な分子標的療法も存在しない。
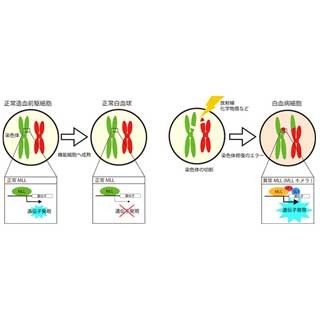
同研究グループは今回、AYA世代のB-ALL患者73例の白血病細胞からメッセンジャーRNAを調整し、それを次世代シーケンサーにより網羅的に解析することで、融合遺伝子の探索を行った。この結果、B-ALLの約65%の症例が何らかの融合型がん遺伝子を有することを発見。このうち、最も多く見られたのはDUX4-IGH融合遺伝子で、2番目に多いものはZNF384融合遺伝子、3番目に多いものは新規MEF2D融合遺伝子となった。
DUX4は健常者の体細胞では発現していないが、遺伝性疾患である顔面肩甲上腕型筋ジストロフィーにおいては高発現して細胞死を誘導し、筋細胞の減少によって筋ジストロフィー症状を示すことが知られている。しかし同解析の結果、AYA世代のB-ALLにおいては、DUX4遺伝子が、後ろ側が削れたうえでIGH座に挿入されて融合し、免疫グロブリン遺伝子転写調節領域の強力な作用によって大量のDUX4-IGHの融合タンパクが産生されることが明らかになった。同融合タンパクは筋ジストロフィーで見られた細胞死誘導能を失っており、代わりに強力な発がん能を獲得することが確認されている。
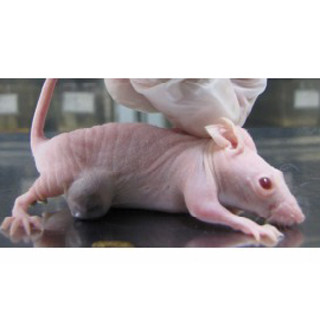
さらに、DUX4-IGH融合タンパクをネズミのB細胞で発現させるとネズミは白血病を発症すること、またDUX4-IGHを持っているB-ALL細胞株でDUX4-IGHの発現を低下させると細胞死が誘導されることも明らかになっており、DUX4-IGHはB-ALLの治療標的となることがわかる。
またAYA世代B-ALLに認められるZNF384融合遺伝子の多くは既知のEP300-ZNF384遺伝子だが、MEF2D遺伝子の融合パートナーは新規のBCL9とHNRNPUL1だった。EP300-ZNF384、MEF2D-BCL9、MEF2D-HNRNPUL1融合遺伝子のいずれも、がん化能を獲得しており、DUX4-IGHと同様にネズミで白血病を発症させることがわかっている。
なおDUX4-IGHは、AYA世代に特異的に存在しており、小児B-ALLには極めてまれにしか存在せず、成人B-ALLでは検出できなかったという。同様にZNF384融合型がん遺伝子もAYA世代特異的な遺伝子融合であった一方、MEF2D融合型がん遺伝子は小児期とAYA世代B-ALLに同じ頻度で見つかり、成人ALLには存在していなかった。
さらに今回の研究では、患者の治療反応性を調べた結果、DUX4-IGHあるいはZNF384融合型がん遺伝子を有する白血病は予後良好群に属し、MEF2D融合型がん遺伝子陽性の白血病は予後不良群に属することも明らかになっている。
同研究グループは今回の発見について、AYA世代B-ALLに対する新しい分子標的治療法開発や、同疾患の速やかな予後予測診断法の実用化につながることが期待されるとしている。