東京大学(東大)は、農研機構食品総合研究所(NARO)、新潟大学との共同研究により、グルコース(ブドウ糖)とグリセロール(グリセリン)が結合した糖グリセロールである「グルコシルグリセロール(GG)」の生成・分解を主反応とする酵素「グルコシルグリセロールホスホリラーゼ(GGP)」の立体構造を、X線結晶構造解析により明らかにしたと発表した。
成果は、東大大学院 農学生命科学研究科の伏信進矢 教授、NAROの北岡本光 上席研究員、新潟大大学院 自然科学研究科の中井博之 助教らの共同研究チームによるもの。研究の詳細な内容は、5月15日付けで「The Journal of Biological Chemistry」オンライン版に掲載された。
GGは化粧品などに含まれる保湿成分であると同時に、お酒や味噌などの発酵食品にも含まれる甘みを持つ食品成分だ。そのGGの「加リン酸分解」または合成反応(生成)を主反応とする酵素として、近年、北岡上席研究員や中井助教らが、アルカリ性で塩分濃度の極めて高い塩湖である米・カリフォルニア州のモノ湖から同定した細菌「バチルス・セレニティレデュセンス」のゲノムから見つけたのがGGPである。
さらにGGPには「加リン酸分解」(リン酸を用いて化合物を分解する反応)の副反応として、GGを分解して得られるリン酸とグルコースの1番炭素がβ結合した糖リン酸「βグルコース-1-リン酸(βG1P)」を加水分解する活性も持ち、グルコースとリン酸を生成することも確認されていた(加リン酸分解反応を触媒する酵素のことをホスホリラーゼという)。しかしGGPの立体構造はわかっておらず、どのようにして複数の反応を触媒するのかが不明だったのである。
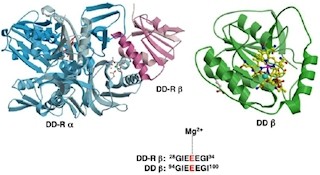
今回、研究チームはGGPの高分解能の3次元構造を、高エネルギー加速器研究機構(KEK)物質構造科学研究所の日本初のX線を利用できる放射光専用光源「フォトンファクトリー」のビームライン「BL-17A」を利用して、X線結晶構造解析の技術を用いて解明。また、決定された構造とコンピュータ解析の結果を基に「点変異体」を用いた機能解析が行われ、GGPの反応のメカニズムが明らかにされたというわけだ。点変異体とは、酵素の特定のアミノ酸残基を別のアミノ酸残基に置換したもののことをいう。目的の残基に変異を入れることで酵素の活性が変われば、その残基の役割を推定できるという仕組みだ。
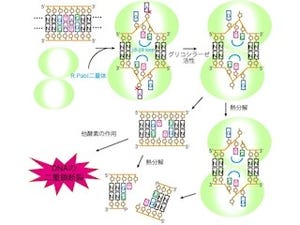
まず、GGPの触媒部位に一連の反応の最終生成物であるグルコースが結合した構造(画像1)と、反応前の状態を模した「イソファゴミン」とグリセロールが両方結合した構造から、GGPのグリセロールが結合する部位は、GGがぴったりと結合できるような特徴的な構造であることが確かめられた。なおイソファゴミンはグルコースに似た化合物で、GGPの触媒を担う部分に強く結合することにより酵素の働きを阻害するという特徴を持つ。
さらに1反応ずつの複合体構造を予測するため、コンピュータを用いた「ドッキング解析」が行われ、GGPにβG1Pが結合した構造が推定された。これらの解析により、一連の反応の構造的な知見が得られたというわけだ(画像2)。その結果、GGを加リン酸分解する第1反応はGGPが属する酵素群に共通してよく知られている反応メカニズムであることが推定されたのである。ドッキング解析とは、コンピュータ解析によって基質と酵素がどのように結合するかを予想する方法のことをいう。
一方、その反応の生成物であるβG1Pを加水分解する第2反応は類似の酵素群には見られないため、そのメカニズムはまったくわかっていなかった。加水分解が起こるためには、水分子がβG1Pのグルコースとリン酸をつなぐ炭素原子を攻撃しなければならない。しかし水分子は常に動き回っており、何らかの作用によって安定化されなければ攻撃をしかけることができない。
そこで研究チームは、この水分子の周辺のアミノ酸残基と、もう1つの水分子が、攻撃をしかける水分子を安定化しているのではないかという仮説を立て、その反応メカニズムを、点変異体を用いた機能解析によって明らかにしたのである(画像3)。
通常1つの酵素は1つの反応を触媒するが、GGPの場合は、前述したように本来の反応(加リン酸分解とその逆反応である合成反応)だけでなく、βG1Pの加水分解も触媒し、複数の反応を触媒するという珍しい特徴を持つ。しかし、この加水分解活性は合成反応の基質でもあるβG1Pを壊してしまうために、GGPをGGの合成に応用しようとする場合には、障害にもなり得るという。今回の成果によって、GGPがどのようにして2つの反応を触媒しているかの分子メカニズムが明らかになり、βG1Pの加水分解反応をどのように抑えればよいかというヒントも得られたとする。
GGPにより生成できるGGは保湿効果があるだけでなく、麹菌の酵素の副反応によっても作られるために、お酒や味噌などに微量に含まれており、甘みを持ち、食品としても安全な物質であることが知られている。そのため、将来的には、化粧品や食品への添加物として大量生産への応用が期待されるという。学術的にはGGPが細菌でどのような生物学的意味を持つのかはいまもって不明だというが、塩湖という高い浸透圧下の極限環境で生き残るための戦略の一環としてGGPが利用されている可能性もあるため、細菌がどのようにして生きているのかを解明する手がかりとなり得るともしている。