九州大学(九大)と科学技術振興機構(JST)は5月13日、神経のダメージで発症する慢性的な痛みである「神経障害性疼痛」の原因タンパク質として「インターフェロン調節因子5(IRF5:interferon regulatory factor 5)」を突き止めたと共同で発表した。
成果は、九大大学院 薬学研究院 薬理学分野の井上和秀主幹教授、同・津田誠准教授らの研究チームによるもの。研究は最先端・次世代研究開発支援プログラム、およびJST 戦略的創造研究推進事業 チーム型研究(CREST)によるもので、詳細な内容は現地時間5月13日付けで英オンライン科学誌「Nature Communications」に掲載された。
がん、糖尿病、帯状疱疹、脳卒中などで神経に障害が起きると、抗炎症薬やモルヒネなどの鎮痛薬が効きにくい神経障害性疼痛が発症する。ひどい場合は、服が肌に触れただけでも痛みを感じるほどとなるが、そのメカニズムは不明で、効果的な治療法もないのが現状だ。
そうした中で研究チームが2012年に明らかにしたのが、脳や脊髄の免疫細胞と呼ばれ、中枢神経系を構成する細胞の約5~20%を占める「ミクログリア」が、神経損傷後の脊髄で活性化した状態になり、それが慢性的な痛みを引き起こしている仕組みだ。
ミクログリアは、神経細胞の障害などにより、細胞の働きを調節するタンパク質が増えることで活性化状態となるが、その中でも、研究チームが2003年に発表した「P2X4受容体」は神経障害性疼痛の発症に非常に重要な役割を果たしていると考えられているという。
P2X4受容体は、細胞の外にある生物のエネルギー源である「アデノシン三リン酸(ATP)」で刺激されるタンパク質だ。細胞膜上にあるイオンチャネル型受容体で、ATPで刺激されると細胞の中に陽イオンを入れ、細胞を興奮させるという機能を持つ。神経の障害後にミクログリアだけで増え、この受容体を遮断する薬物で痛みが緩和されることはわかっているが、どのようなメカニズムでミクログリアの中だけで増えるのかはこれまでわかっていなかった。
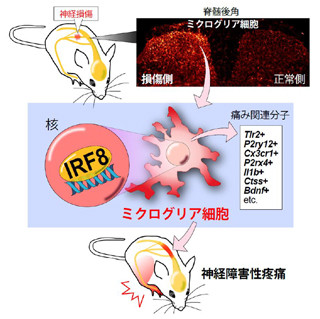
そうした背景の中、研究チームが神経を損傷させたマウスの脊髄において今回発見したのが、さまざまな遺伝子の発現をコントロールするタンパク質「IRF5」がミクログリアの中だけで増えるという事実だ。この増加は、同じく研究チームが2012年に発表したタンパク質「IRF8」によって調節されていることもわかった。なおIRF5はインターフェロン調節因子ファミリーに属し、細胞の核内にあるDNAに結合して、さまざまな分子の発現を調節し、免疫制御に関わっているが、これまでは脳や脊髄における役割はわかっていなかったという具合だ。
また、IRF5を作り出せないように遺伝子を操作したマウス(IRF5遺伝子欠損マウス)では、神経損傷後の痛みが弱くなっていることも確認されたのである。さらに、IRF5がP2X4受容体の調節に必要な遺伝子領域に作用し、P2X4受容体を増やすように働いていることも明らかにされた。従って、神経損傷後、IRF8によってミクログリアで増えるIRF5がP2X4受容体を増やすという一連の流れが、神経障害性疼痛を引き起こす原因であることが明らかになったのである(画像)。
IRF5は一連の流れの中でミクログリアを「痛みモード」にかえる実行役のような働きをしている。従って、IRF5の働きを抑える薬を開発することができれば、ミクログリアを正常化させ、神経障害性疼痛を緩和できる可能性があるとした。現在、同・大学院薬学研究院では、既承認医薬品から新しい作用を見つけ、より早く臨床で使用できるようにするための研究「エコファーマ」を同研究院附属 産学官連携創薬育薬センターにおいて推進しており、今後、IRF5が増えるのを抑制する、もしくはIRF5がP2X4受容体遺伝子に作用するのを抑制する薬などを既承認医薬品から探索する計画を検討しているとしている。