理化学研究所(理研)、兵庫県立大学、高輝度光科学研究センター(JASRI)、大阪大学、岡山大学は5月9日、X線自由電子レーザー(XFEL:X-ray Free-Electron Laser)施設「SACLA(SPring-8Angstrom Compact free-electron LAser:サクラ)」が発振するX線レーザーを用いる「フェムト秒X線レーザー結晶構造解析法」の開発に成功したと共同で発表した。
成果は、理研 放射光科学総合研究センター ビームライン基盤研究部の平田邦生専任技師、同・吾郷日出夫専任研究員、同・山本雅貴部長と、兵庫県立大の新澤(伊藤)恭子准教授、同・吉川信也特任教授らの共同研究チームによるもの。研究の詳細な内容は、日本時間5月12日付けで英科学誌「Nature Methods」に掲載された。
1910年代に発見されたX線回折は、さまざまな結晶の原子配列(結晶構造)やDNAの2重らせん構造の発見など、数多くの科学的な業績を支えてきた。現在は「放射光」という明るいX線光源の登場で急速に研究が進み、生命科学の分野では構造解析済みの10万近いタンパク質の内、およそ8割が放射光を利用したX線結晶構造解析で決定されているという具合だ。
その一方で、放射光を光源とするX線結晶構造解析には長年の課題もあった。高いエネルギーを持つX線と相互作用した分子が壊れてしまう「放射線損傷」である(X線の直接作用だけでなく、分子が壊れる過程で生じる電子や壊れた分子から生成される反応性の高い分子が観察対象の分子と化学反応を起こしてしまうケースもある)。
多くの水が含まれているタンパク質の結晶では、X線照射後、ピコ秒の極短時間で、水が高い反応性を持つ分子に変化してしまう。その結果、その望んでいないのにできてしまった反応性の分子との化学反応で、タンパク質の構造が変わってしまうのだ。例えていうなら、屋内の暗いところで人物を撮影したいのでフラッシュを使ったら、フラッシュのまぶしさでその人物が目を閉じてしまったようなイメージといえばいいだろうか。もしくは、ビーム兵器をフラッシュの代わりに使っているようなイメージである。
中でも、タンパク質の機能を担い、酵素反応が起きるタンパク質上の部位である「活性部位」は放射線損傷が起きやすい場所だ。一般に活性部位には、酵素反応を進めるために、電子分布の偏りを持ったアミノ酸の側鎖や電子が豊富な金属イオンが官能基として存在している。これらの官能基は比較的反応性が高いため、X線照射で水から生じた反応性分子の攻撃を受けやすいのだ。そのため、活性部位の正確な3次元原子構造を正確にとらえることが困難になり、タンパク質の働く仕組みを知る上での障害となる場合があった。このため、放射線損傷の影響を受けることなく、高い精度で立体構造を決定できる新しいX線結晶構造解析の方法が求められてきたのである。
一方、SACLAのX線レーザーは、理研が所有しJASRIが運用する大型放射光施設「SPring-8」(SACLAはそのすぐ横に建設されている)の10億倍も明るく、放射線損傷が起こるピコ秒の100分の1の時間である10フェムト秒という超極短時間のX線照射で、構造解析に必要なX線回折写真を撮影することが可能だ。要は、放射線損傷が起きるよりも早くデータの測定を行えるというわけである。
今回、結晶構造解析の対象とした「チトクロム酸化酵素」の活性部位は、X線に対して感受性が高い。放射線損傷によってわずかだが無視できない構造変化が起きるため、これまでの長きにわたって、その働く仕組みを解明することができなかったタンパク質(酵素)の1つだった。そこで研究チームは今回、チトクロム酸化酵素を対象とした検証を行い、フェムト秒X線レーザー結晶構造解析が、X線に非常に感受性の高いタンパク質であっても、放射線損傷の影響を受けることなく、かつ高精度で、タンパク質の正確な構造を決められることの証明に取り組んだのである。
チトクロム酸化酵素は、ヒトを初めとする酸素呼吸をする生物の生体活動のエネルギー物質である「アデノシン三リン酸(ATP)」の産生の鍵となる、生命の根源的な機能を担うといっていい膜タンパク質だ(画像1)。その活性部位(画像1の赤丸)で呼吸で取り込んだ空気中の酸素を水に還元して得られる自由エネルギーで駆動する「水素イオン輸送ポンプ」であり、生体膜を挟んだ水素イオン濃度差を作る。この水素イオン濃度差を使って、生体活動のエネルギー物質であるATPが生合成されるのだ。
チトクロム酸化酵素は、このように空気中の酸素を水に還元して、ATP産生につながるエネルギーを取り出しているのだが、酸素から変化したどのような分子が、どのようにして活性部位に結合しているのかを知ることは、チトクロム酸化酵素の働きを知る上で必要な基本情報というわけだ。
生化学的および分光学的実験結果によれば、過酸化物陰イオンが、酵素反応前のチトクロム酸化酵素の活性部位に結合しているといわれている。しかし、放射光X線結晶構造解析では、過酸化物陰イオンとしては通常あり得ない酸素原子間の距離が解析結果として示されており(画像2)、正確な活性部位の様子を知ることはできないままだった。
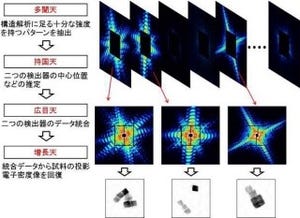
フェムト秒X線レーザー結晶構造解析では、SACLAのX線レーザーと大きな結晶の組み合わせが不可欠だ。前述したように、極めて短い時間に大量のX線を結晶に送り込むことができるSACLAのX線レーザーを使うと、放射線損傷の元となる反応性の高い分子が作られるより早く、構造解析で使うデータを集めることができる。先程のカメラでいえば、目を閉じる間もない早いタイミングでフラッシュを焚くようなイメージだ。これは、放射線損傷のないX線結晶構造解析の必要条件である。それに加え、SACLAのX線レーザーを大きな結晶に照射して、より多くのタンパク質とX線とを相互作用させることで、高い精度で構造を決めるために不可欠な、鮮明なX線回折写真を撮影できるというわけだ。
SACLAのX線レーザーを使ったフェムト秒X線レーザー結晶構造解析を実現するため、研究チームは1μmのSACLAのX線レーザーを、結晶上の狙った部位にμm精度で照射できる回折実験装置を製作した(画像3)。X線結晶構造解析では、さまざまな方向からX線を結晶に当て、1組の3次元的なX線回折写真を撮影する必要がある。しかし、一度X線を受けた部位では、放射線損傷が起きているので、放射線損傷のない構造解析では、結晶の動きを精密に制御し、常に新しい部位にSACLAのX線レーザーを照射してX線回折写真を撮影することが欠かせないというわけだ(画像4・5)。
フェムト秒X線レーザー結晶構造解析で集めた放射線損傷のないデータの電子密度は、過酸化物陰イオンが取りうる1.55オングストローム(Å)の原子間距離を示していることが確認された(画像6)。この結果は、フェムト秒X線レーザー結晶構造解析で放射線損傷のないX線結晶構造解析ができることの証明になるという。
次に、過酸化物陰イオン(画像7の赤矢印)のX線による光分解で生成した水分子が、活性部位のアミノ酸残基チロシン244番に捕獲される現象(画像7のAの電子密度)が注目された。活性部位のアミノ酸残基チロシン244番に捕獲された水分子の電子密度の高さは、フェムト秒X線レーザー結晶構造解析では0.38。この値は、X線によって水分子を生成しないシアン化物イオンを結合したチトクロム酸化酵素の結果と同等だったとした(画像8)。この結果は、X線レーザーの10フェムト秒という超短時間の照射の間には、過酸化物陰イオンのX線による光分解が起こらなかったことを示す明確な指標で、フェムト秒X線レーザー結晶構造解析で放射線損傷のないX線結晶構造解析ができることの証明になるとする。
2通りの観点から、フェムト秒X線レーザー結晶構造解析で放射線損傷のないX線結晶構造解析が可能なことから、チトクロム酸化酵素の活性部位の正確な構造をさらに詳細に調べたところ、存在比率の異なる過酸化物イオンが、2つの金属イオンの双方に結合を持つ構造が明らかになった(画像9)。この構造は、これまでに知られている活性部位の磁気的な性質と矛盾がなく、かつ、上述の生化学的分光学的実験結果とも一致する。従って、この構造はX線照射の影響を受けていない正確な活性部位の構造であると結論することができる。
|
|
|
|
画像8(左):画像7の示す電子密度Aの高さの比較。画像9(右):放射線損傷の影響のないチトクロム酸化酵素の活性部位の構造。画像2の左の銅イオン(CuB)からヘムa3(Fea3とそれを囲む窒素:N)に相当する部分 |
|
SACLAのX線レーザーの利用で実現した新しい結晶構造解析の方法「フェムト秒X線レーザー結晶構造解析」は、X線に非常に敏感なタンパク質であっても、X線を照射する前の正確な構造を解析することが可能だ。高い効率と正確さを持って機能する、優れた分子機械であるタンパク質の精緻な構造を、創薬などの「ものづくり」の設計に取り込む可能性が高まると期待できるという。
またフェムト秒X線レーザー結晶構造解析法は、タンパク質の働く様子の一瞬一瞬を精密に描き出す「高精度高速時分割構造解析法」を開発するための基盤となる技術だ。タンパク質の働きの高い正確さと高効率性は、タンパク質の正確な「動き」に依存している。
例えば、常温という穏和な環境で化学反応を進める酵素タンパク質の触媒としての働きは、基質が産物へ変換される化学反応の過程で一瞬だけ現れる、反応中の分子が特別に高いエネルギー状態である「遷移状態」の構造と相補的な構造に、タンパク質の構造が一瞬変化して強く結合することで実現されている。
SACLAの大強度極短パルスX線レーザーが可能にしたフェムト秒の露光時間を活用した高精度高速時分割構造解析法が完成すると、人工触媒デザインの究極のターゲットである「一瞬だけ現れるタンパク質と遷移状態における分子の複合体の構造」だけでなく、タンパク質の働く様子の一瞬一瞬を正確に見ることができるようになるという。これによって、タンパク質が働く仕組みの全容を初めて知ることができるというわけだ。これまでの技術では手が届かなかったタンパク質の瞬間的な働きの動的な情報を、SACLAを使って引き出すための第1歩が、フェムト秒X線レーザー結晶構造解析の開発だとしている。