名古屋大学(名大)は5月2日、がん細胞の集団が異なる特徴を持つ細胞を生み出すことで、周辺の組織に浸潤する分子的なメカニズムを解明したと発表した。
成果は、名大大学院 医学系研究科 分子病理学・腫瘍病理学分野の高橋雅英 教授、同・加藤琢也 特任助教らの研究チームによるもの。研究の詳細な内容は、米国東部時間5月1日付けで米科学誌「Cell Reports」に掲載された。
これまでのがん細胞株を用いた実験結果から、がん細胞が隣接する組織に浸潤するためには、「上皮-間葉転換(Epithelial-Mesenchymal Transition:EMT)」を経てがん細胞同士の接着性を失うことが重要であるという説が唱えられている。
しかし、患者から摘出されたがん組織ではEMTの瞬間は観察されておらず、EMTに依らない浸潤様式の存在も示唆されている状況だ。実際、近年になってがん組織の観察やがん細胞のライブイメージングなどの技術が発達したことから、がん細胞同士が強固に接着し、集団を維持したまま浸潤し得ることも明らかになってきている。このことは、がん細胞の「集団的浸潤」として注目を集め始めているという。
がん細胞の集団的浸潤では、集団内の先頭を進む「先導細胞(leading cells:LC's)」と「後続細胞(following cells:FC's)」の2種類の細胞が生じ、効率的な浸潤に寄与していると考えられている。しかし、がん細胞の集団がどのようなメカニズムでこれらの細胞を生み出すのかは明らかになっていない。
そこで研究チームは今回、がん細胞株を用いて、培養ディッシュ上にがん細胞の集団を形成させ、LC'sとFC'sにおける遺伝子発現の比較を実施することにした。すると、LC'sの細胞運動関連分子である「インテグリンβ1」の発現が高いことを確認。さらに、LC'sにおけるインテグリンβ1の高い発現が2つの転写調節因子「TRIM27」と「MRTF-B」による「マイクロRNA-124(miR-124)」の発現抑制に依存していることも解明したのである。
ちなみに、miR-124はインテグリンβ1のメッセンジャーRNA(mRNA)を標的としてそのタンパク質合成を阻害することが知られており、miR-124の発現が抑制されることで、LC'sにおいてインテグリンβ1の発現が増加することも確認された。
なおTRIM27/MRTF-BによるmiR-124の発現抑制は、先導端側で隣接する細胞の存在しない(=細胞間接着がない)LC'sのみで観察されたという。つまり、がん細胞は集団内での位置、特に先端にいるのかどうかを感知して遺伝子発現を抑制していることを示しているというわけだ。
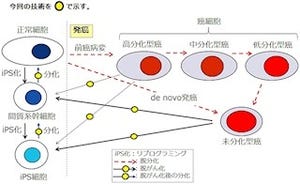
一方、FC'sでは周囲をほかの細胞に囲まれているために細胞間接着が失われず、LC'sで見られたようなインテグリンβ1の発現上昇は起こらなかったことが確認された。これらの結果から、がん細胞集団内では細胞間接着の有無、さらには細胞の位置に依存して、細胞が異なる遺伝子発現を示すことが明らかとなったというわけである(画像1)。
このLC'sに特異的なインテグリンβ1の高発現は、LC'sの特徴の1つと考えられるという。ただし、その浸潤・転移における意義は不明であることから、研究チームは次に浸潤および腫瘍移植マウスにおける転移モデルを用いて、インテグリンβ1発現の意義に対する検討を行った。すると、LC'sにおけるインテグリンβ1の発現は、がん細胞の集団的浸潤と転移の双方に重要であることが判明したというわけである(画像2)。
|
|
|
|
画像1・2:LC'sでは先導端に同種の細胞が存在しないことが引き金となり、TRIM27/MRTF-Bが活性化。その結果、miR-124の発現が抑制され、インテグリンβ1の発現が上昇。一方、FC'sでは周囲を同種の細胞に囲まれているため、TRIM27/MRTF-BによるmiR-124の発現抑制が起こらず、インテグリンβ1の発現は増加しない |
|
今回の成果により、集団内のがん細胞は自信が位置する場所に応じて遺伝子の発現を変化させていることが判明した形だ。がんは多様な細胞によって構成される組織であり、その多様性ががん細胞の悪性化や進行に重要な役割を果たしていると考えられ、今回の成果はその多様性を生み出す機構の1つとしてとらえることができるという。今後は、この機構ががん組織全体の多様性、ひいてはがんの進行にどのように寄与しているのかをさらに詳しく調べていく予定としている。