慶應義塾大学(慶応大)は1月22日、脳の海馬が形成される過程で、神経細胞が誕生してから形を変え機能する場所まで移動する様式を明らかにしたと発表した。
成果は、慶應大 医学部解剖学教室の仲嶋一範 教授らの研究チームによるもの。研究の詳細な内容は、米国東部時間1月22日付けで米神経科学誌「The Journal of Neuroscience」に掲載された。
大脳の「側頭葉」の内側に位置する海馬は、記憶や学習などの脳の機能に重要な部位である。海馬が何らかの障害を受けると、記憶や認知などの問題が生じてしまう。例えばアルツハイマー型認知症では、初期段階で海馬が萎縮することが知られている。
よって海馬が正常に働くためには、適切に形成される必要があり、この形成段階での異常がてんかんや統合失調症といった精神神経疾患の発症に関わる可能性が示唆されているところだ。しかし、脳の発生に関する研究は、大脳皮質の中でも進化的に新しいとされる(大脳)新皮質に焦点が当てられ、進化的にやや古いとされる海馬については研究が不十分で、その形成の仕組みはこれまでよくわかっていなかった。
脳の神経細胞は、深部にある幹細胞から細胞分裂によって誕生した後、その場に留まるのではなく、脳の深部から脳表面まで縦に走る1本の線維「放射状グリア線維」に沿って長い距離を移動してから特定の場所に配置され、ネットワークを作っていく。
海馬の神経細胞についても、深部で誕生後、脳表面側の最終配置部位へと移動することは知られていた。ところが、最終配置部位への移動距離が短いにも関わらず、新皮質の細胞よりも長い時間をかけて移動することが指摘されており、そのことが長年の大きな謎だったのである。
そこで研究チームは今回、仲嶋研究室によって2001年に開発された「生きた神経細胞を光らせて可視化する技術」である「子宮内電気穿孔法」をマウスの海馬に応用。子宮内電気穿孔法は簡便なinvivo(生体内で、という意味)遺伝子導入技術で、マウス胎児の脳に任意の遺伝子を任意の場所と時間に導入することが可能だ。
子宮内電気穿孔法を用いて形成過程にあるマウス海馬の「CA1」領域の錐体細胞に、蛍光タンパク質を発現させて可視化し、神経細胞が誕生からどのように形を変え、移動していくのか、知見が蓄積されている新皮質と比較しながら調べることにしたのである。
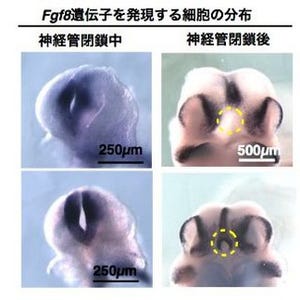
そして今回は、個々の神経細胞の形をはっきりと可視化するために、遺伝子を発現させる仕組みや濃度に工夫が加えられ、あえて「まばら」に神経細胞をラベルする技術「Sparse-Cell Labeling」も新たに確立された(画像1・2)。このように可視化された神経細胞は、蛍光顕微鏡を用いて生きたまま観察することが可能だ。培養を続けながら、神経細胞が脳の組織の中を移動する様子を、動画として記録・解析された。
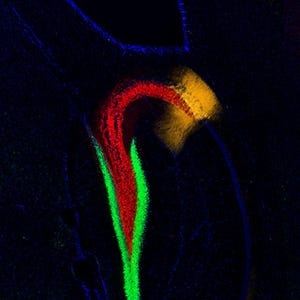
この観察の結果、海馬で誕生した神経細胞は、そのすぐ直上で多くの突起を持ったまましばらく留まる点では新皮質と共通であることが判明。その際に、多くの突起を伸縮する特徴的な動きを示す点も、新皮質と共通していたのである。その動きは、以前に仲嶋研究室によって新皮質で発見されて命名された「多極性移動」と呼ばれる動きだった(画像3)。
しかしその留まる時間は、発生の後期に誕生する神経細胞ほど著しく長くなることも確認された。これが海馬神経細胞の長い移動時間の原因の1つであると考えられるという。この新たに判明した、発生の時期によって大きく異なる停留時間の違いは、今後、海馬の神経細胞移動を解析する際に重要な基礎情報となるとする。
さらに観察が続けられ、神経細胞は一定期間、誕生場所近くで留まった後、脳表面に向けて移動を開始するが、その移動様式には、海馬と新皮質の間で大きな相違が見られたという。新皮質では、細胞は1本の先導突起を伸ばして放射状グリア線維を足場として「登り棒」を登るように脳表面に向かって一気に直線的に移動していく「ロコモーション様式」だった。
それに対して海馬においては、複雑な分岐のある複数の先導突起をさかんに伸縮させて、多くの放射状グリア線維につかまりながらある程度移動したら一時停止して、再び複数の方向に突起を伸ばし、足場となる放射状グリア線維を探るように交代させながらゆっくり移動していくことがわかったのである(画像3~5)。その結果、海馬の神経細胞はジグザグとゆっくり移動していくことが判明(画像6~7)。その様子はロッククライマーの動きにも似ていることから、新たに見出されたこの細胞移動様式は「クライミング様式」と命名された。
|
|
|
|
大脳新皮質(画像6:左)と海馬(画像7:右)の細胞移動の解析緑色に光らせて可視化した神経細胞が移動する様子を、動画として記録・解析した。白い線は神経細胞の移動の軌跡を、紫色の矢印は各時点での移動速度と方向を表している。大脳新皮質の細胞は直線的に移動するのに対し、海馬の神経細胞は移動方向を変えながらジグザグに移動する様子がわかる |
|
海馬は記憶や学習に必須の部位であることは冒頭で述べた通りで、現在も多くの研究領域で研究題材として用いられている。今回の成果では、ほかの研究領域においても重要な基盤となる海馬の形成過程についての根本的な情報を提供することができたという。
また生物の系統発生の観点から、海馬は新皮質と比べて進化的に古い脳と考えられている。ヒトをはじめとするほ乳類では新皮質が高度に発達しているのはご存じの通りだ。今回、海馬と新皮質ではその細胞移動の様式が異なることが判明したことから、新しい移動様式の獲得が新皮質の発達に貢献した可能性も考えられ、脳の進化を考える上でも、重要な情報が得られたとする。
さらに、てんかんや統合失調症の病理解剖された脳などを用いた従来の解析から、これらの疾患では海馬の神経細胞に配置や配向の異常が見られることも報告されていた。これらの異常は、発生段階における神経細胞移動の障害に起因すると考えられるという。今回判明した、神経細胞移動に関する基本的な情報は、上記の精神・神経疾患の病態を解明する上でもその糸口になると考えられるとした。
加えて、今後、脳の再生医療研究が進むと、将来的には脳血管障害や変性疾患などに対する幹細胞治療などが積極的に試みられるようになると考えられるとする。その一方で、脳においては多様な神経細胞が精密に配置されることが機能の発揮に重要なのはいうまでもない。今回の研究は将来の再生医療において、神経細胞を適切に配置させるためにも重要な示唆を与えると考えられるという。このように、今回の海馬の神経細胞移動に関する発見によって、今後の病態理解や治療法の開発に新たな進展が得られることが期待されるとしている。