京都大学 iPS細胞研究所(CiRA)は1月8日、大阪大学、味の素との共同研究により、細胞移植治療に適したiPS細胞の新しい樹立・維持培養法を確立したと発表した。
成果は、CiRAの中川誠人講師、同・山中伸弥教授らの共同研究チームによるもの。研究の詳細な内容は、現地時間1月8日付けで英オンライン総合学術誌「Scientific Reports」に掲載された。
ES細胞やiPS細胞を使った治療に関する研究は着々と進んでいる。例えば米国では、Advanced Cell TechnologyがES細胞から作製した細胞を用いて眼疾患の臨床試験を行って成果を上げたし、最終的には経営上の理由から中止となったが、ジェロン社も同じくES細胞から作製した神経細胞を用いて脊髄損傷の臨床試験を実施した。
日本においては、2013年7月に理化学研究所 発生・再生総合科学研究センターの高橋政代博士らのグループにより、加齢黄斑変性に対する世界初のiPS細胞を使った臨床研究が正式に厚生労働省に認められており、iPS/ES細胞を使った治療が本格的にヒトで行われる日も近づいてきた。
通常、ヒトiPS/ES細胞を研究で使用する際には、マウスの「フィーダー細胞」や、ウシの血清を含んだ培地が広く使われている。フィーダー細胞とは、目的の細胞を培養する際、培養条件を整える補助的な役割を持つ細胞のことをいう。iPS細胞の培養の際には、マウス胎仔由来の線維芽細胞などがフィーダー細胞として用いられている。ただし、フィーダー細胞の準備には多くの時間と労力が必要で、フィーダー細胞を育てる培地にはウシ胎児血清が含まれているのが通常だ。
しかしこうした煩雑な操作や動物由来の成分は、最終的に得られる細胞の品質を不安定にする要因となるため、移植に使う細胞に要求されるGMP基準を満たすためには、血清などの動物由来の成分をできるだけ取り除く必要がある。
これまでに、フィーダー細胞の代わりとなるタンパク質や動物由来成分を含まない培地は開発されていたが、ヒトiPS細胞やヒトES細胞を安定的に効率よく培養できる組み合わせは得られていなかった。
そこで研究チームがフィーダー細胞の代わりとして着目したのが、初期胚の多能性幹細胞が足場とする接着タンパク質の「ラミニン-511」だ。ヒトES/iPS細胞に対して非常に強い接着活性を示すのが特徴である。そして、そのラミニン-511の活性部位を含む短い断片である「ラミニン-511E8断片(LN511E8)」は、全長のラミニン-511と同等以上の細胞接着活性を持つ。LN511E8はヒトiPS細胞やES細胞の維持に有効というわけだ。
またLN511E8は、タグをつけたリコンビナント「rLN511E8」を使うことで大量にかつ高純度のものが得られるため、rLN511E8をフィーダー細胞の代わりとして採用することにしたという。なお、リコンビナントとは、遺伝子組換え技術によって人工的に作製されたタンパク質のことだ。印をつけることでほかのタンパク質と容易に見分けることができるようになる特徴を持つ。
次にrLN511E8を使った環境でヒトiPS細胞やヒトES細胞の培養に最適な「Xeno-free(Xf)培地」が選出された。テスト培地の作成と培養による検証が根気よく繰り返された結果、味の素社との共同開発による動物由来の成分が含まれていないXf培地で、効率よくiPS細胞を維持増殖させることができる成分の組み合わせがついに見出されたのである。
iPS細胞から誘導した細胞を移植するためには、iPS細胞の樹立過程も、ヒトの皮膚や血液の細胞からフィーダー細胞を使わない「Feeder-free(Ff)」かつXfである必要がある。今回開発されたrLN511E8と培地を使うことで、線維芽細胞や血液細胞(T細胞・T細胞以外の細胞・臍帯血細胞)からiPS細胞を樹立することに成功した(画像1)。
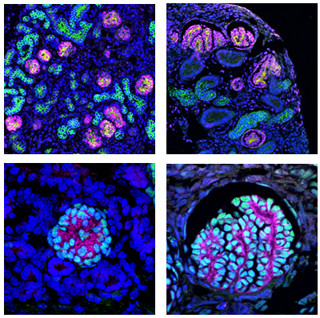
また、FfかつXfの環境で樹立・培養したiPS細胞の分化能力についての検討も実施。iPS細胞の分化能力を調べる方法として、iPS細胞を免疫不全マウスに移植して「テラトーマ」の形成を観察する方法がよく使われている。今回開発されたFfかつXfの環境で作製したiPS細胞はテラトーマを形成し、3胚葉すべてに分化する能力を示すのが確認された(画像2)。
また、臨床応用に向けて必要となる代表的な細胞種として、神経細胞・血液細胞・インスリン産生細胞へとiPS細胞が分化誘導され、その結果、いずれの細胞にも分化する能力があることが示されたという(画像3)。
今回新しく開発されたFfかつXfの樹立・培養方法により、フィーダーを使った方法と比べても遜色のない、高効率のiPS細胞の維持培養が可能となった。この方法は操作が容易であり、発展性・再現性に優れており、GMPに準拠した医療に使用するヒトiPS細胞を作製する方法として有効だという。さらに、薬剤スクリーニングや基礎研究へも幅広く応用できると考えられるとしている。