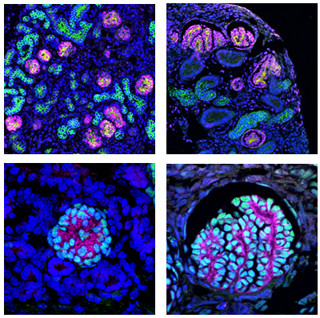
熊本大学は、リンパ節内の胚中心と呼ばれる増殖が活発な領域で発現上昇する分子「GANP分子」が、白血球の一種で後天性免疫不全症候群(AIDS)の原因となるウイルスHIV-1が感染する感染細胞である「CD4陽性ヘルパーT細胞」内で増加し、HIV-1ウイルス内に感染能力を消失させる分子であるシチジン脱アミノ化酵素「APOBEC3G」を送り込む能力を有していることを発見したと発表した。
同成果は、同大大学院生命科学研究部の阪口薫雄 教授、同大大学院生命科学研究部感染免疫学講座免疫学分野の前田和彦 助教、同大 Sarah Ameen Almofty大学院生(サウジアラビア王国国費留学生)らによるもの。詳細は科学雑誌「米国免疫学会誌(The Journal of Immunology)」に掲載された。また、GANP分子は同研究グループが2000年に発見したものである。
HIV-1ウイルスは、免疫細胞であるCD4陽性ヘルパーT細胞に侵入して慢性の経過を経てヘルパーT細胞を破壊し、免疫不全を引き起こすことがこれまでの研究から分かっているが、HIV-1ウイルスはヘルパーT細胞内で変異し薬剤耐性を獲得するため、継続的な治療薬の開発が求められている。
近年の研究から、生体にはHIV-1ウイルスに対して抵抗可能な自然治癒能力が有ると考えられるようになってきており、中でも遺伝子を直接変異させるAPOBEC3Gシチジン脱アミノ化酵素はHIVウイルスの遺伝子破壊を引き起こすことで感染能力を喪失させる防御因子であることが分かってきたが、効率よくHIVウイルス内に送り込むことは困難であった。
今回の研究では、CD4陽性ヘルパーT細胞の活性化によって増加したGANP分子が、APOBEC3Gをウイルス粒子のコアまで運び込み、APOBEC3Gとともに暴れ回る機能を持ち、結果として感染能力を抑制することを確認したという。同現象はエイズ感染をしても、生体内で不活性化したウイルスを作り出すことが出来ることを示したもので、この結果から、ウイルスの感染能力を消失させる分子を効率よくHIVウイルスへ送り込むことができるようになり、これによりエイズ感染後も継続して免疫機能を高め、ウイルス変異に備えることを可能とする「生体内ワクチンの誘導」という新しい治療技術によるエイズ治療が期待できるようになると研究グループではコメントしている。