京都大学は11月4日、自然免疫機構による生体の炎症応答に重要な「インフラマソーム」を構成する連結因子「ASC(Apoptosis-associated speck-like protein containing caspase recruitment domain)」分子の活性化機構を解明し、ASCの特定部位のリン酸化がインフラマソームの制御に必須であることを見い出したと発表した。
成果は、京大 医学研究科の原英樹助教、同・土屋晃介助教、同・河村伊久雄准教授、同・光山正雄名誉教授(現・総合生存学館特定教授)らの研究チームによるもの。研究の詳細な内容は、米国東部時間11月3日付けで英科学誌「Nature Immunology」に掲載された。
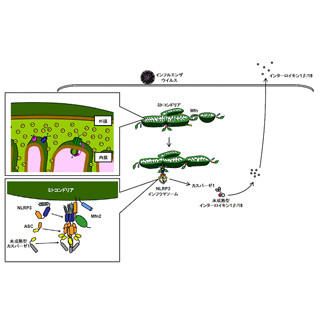
自然免疫は下等生物から高等生物まで保存された生体防御機構であり、多数のパターン認識受容体が自然免疫応答の中心的役割を担っている。「NLRP3」や「AIM2」、「NLRC4」などのパターン認識受容体は、特定の「アゴニスト(刺激因子)」を認識すると構造変化を起こしてASCや、タンパク分解酵素(システインプロテアーゼ)の1種である「カスパーゼ-1」などのタンパク質と介合し、インフラマソームと呼ばれるタンパク複合体を形成する(画像1)。
インフラマソームではカスパーゼ-1が活性化され、活性型カスパーゼ-1が「インターロイキン(IL)-1」などの炎症性サイトカインの成熟化・分泌を誘導することで炎症が起こるという仕組みだ(「未熟型IL-1β」を分解することで成熟化させ、「成熟型IL-1β」は強力な炎症性サイトカインとして働く)。
インフラマソームの形成は病原微生物の感染によって誘導され、それに基づく炎症応答は多くの場合、感染防御に有効であり、インフラマソームは腸内細菌叢の制御および腸管上皮バリアの保護に働き、腸管の恒常性維持に寄与するとも考えられている。
一方、インフラマソームが示す負の側面も知られており、刺激因子の種類によっては、過剰なインフラマソーム形成が不適切かつ持続した炎症を惹起し、動脈硬化、痛風、2型糖尿病、アルツハイマー病などの各種疾患の発症に関わる形だ。
また、ある種の自己炎症疾患の発症はインフラマソーム構成タンパクの突然変異が関与することも示唆されている。そのため、インフラマソームの形成または活性の制御機構を解明することは、病態機構の理解を深め、診断や治療へ貢献するものと期待されているというわけだ。
インフラマソーム構成タンパクであるASCは、インフラマソームにおいては受容体とカスパーゼ-1の介合を助ける連結因子として働くが、インフラマソームが形成される際に自身が凝集化して別のタンパク質複合体「ASCスペック」を形成する(画像1~3)。
ASCスペックは、インフラマソームと同様にカスパーゼ-1を呼び寄せてカスパーゼ-1活性化の場として働くことから、インフラマソームを介した炎症応答で重要な役割を果たしていることはわかっていた。しかし、ASCスペックの形成がどのような機序で誘導されるかはこれまで明らかではなかったのである。
|
|
|
|
ASCと核をそれぞれ赤色および青色の蛍光色素で染色した後、蛍光顕微鏡で観察されたもの。画像2(左)は未処理マクロファージ、画像3(右)は「ナイジェリシン」で刺激された免疫細胞の1種「マクロファージ」が写っている。ASCは未処理マクロファージでは細胞内に遍在するが、ナイジェリシン刺激によってNLRP3インフラマソームが活性化されると凝集化してASCスペックを形成する(1例を矢印で示す) |
|
研究チームは今回、インフラマソームの形成や活性に関わるシグナル伝達経路を探索する目的で、各種シグナル阻害剤のインフラマソームへの影響を調べた。その結果、キナーゼである「Syk」および「JNK」が、NLRP3インフラマソームおよびAIM2インフラマソームを介したカスパーゼ-1活性化や炎症性サイトカインの産生に関わることがわかった。
そこで、なぜSykとJNKがインフラマソームの活性に関わるかが調べられることとなった。そしてさまざまな可能性が検討され、ASCスペックの形成がこれらのキナーゼに依存していることが確認されたのである。すなわち、SykとJNKはASCスペックの形成を制御することで、インフラマソームを介した炎症応答に寄与することが示唆されたというわけだ。
次に、SykとJNKがどのような機序でASCスペックの形成を制御するかが検討された。さらにSykとJNKがキナーゼであることから、インフラマソーム構成タンパク質のリン酸化が関与する可能性が考えられ、インフラマソーム形成時にリン酸化されるタンパクの検査がなされた結果、ASCがSykおよびJNKに依存してリン酸化されることが明らかになったのである。
また、ASCの144番目のチロシン残基(Y144)がリン酸化部位であることを同定することに成功。さらに、Y144の変異体を用いた実験により、同アミノ酸残基がASCスペックの形成や炎症性サイトカインの産生誘導に重要であることもわかった。これらの実験結果から、SykおよびJNKに依存したASCの特定のチロシンリン酸化が、ASCスペックの形成に重要な役割を果たし、インフラマソームを介した炎症応答の誘導に働くことが示されたのである(画像4)。
次に、明らかになったSykおよびJNKのインフラマソームへの関与が生体内で再現できるか、マウスの「117モデルを用いて検討がなされた。マウスの腹腔に「尿酸結晶」を投与するとインフラマソーム依存的に「好中球浸潤」が起こることが知られているが、SykまたはJNKの非存在下では尿酸結晶による好中球浸潤の誘導が有意に減少していたため、これらのキナーゼは生体内においてもインフラマソームを介した炎症応答の誘導に働くことが確認されたのである。
これまで、ASCスペックの形成は単純にASC分子の凝集現象と考えられてきた。しかし、キナーゼによるASCのリン酸化がその過程に重要な役割を果たすことが今回の研究で判明。キナーゼによるタンパクのリン酸化反応は化合物による抑制が比較的容易であることから、ASCのリン酸化を特異的に阻害する化合物の探索、設計により、インフラマソームを介した炎症応答の制御、ひいてはインフラマソーム関連疾患の治療に応用することも期待できるという。
また今後の展開としては、ASCのリン酸化がASCスペックの形成に働く、さらに詳細なメカニズムを明らかにする必要があるとする。また、自己炎症疾患のモデルマウスなどを用いて、SykやJNKの阻害が実際に症状を緩和するか否かも確かめる必要があるとした。