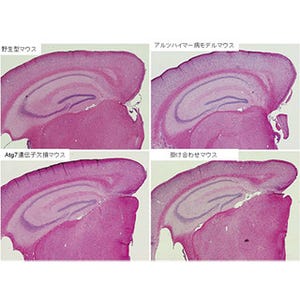
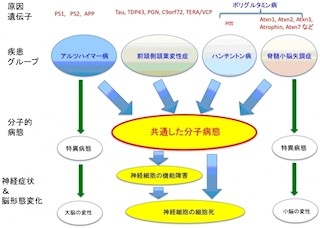
東京医科歯科大学(TMDU)と科学技術振興機構(JST)は10月31日、英・インペリアルカレッジとの共同研究により、神経変性疾患の「脊髄小脳失調症1型(SCA1:Spinocerebellar Ataxia type1)」の病態に重要な役割を果たす遺伝子を特定したと共同で発表した。
成果は、TMDU 岡澤均教授、同・田村拓也助教、インペリアルカレッジのサム・バークレー医師らの国際共同研究チームによるもの。研究はJST課題達成型基礎研究の一環として行われ、その詳細な内容は現地時間10月31日付けで英科学誌「Human Molecular Genetics」オンライン速報版に掲載された。
SCA1は優性遺伝性形式を取る遺伝病で、「プルキンエ細胞」、「歯状核」といった小脳神経細胞の変性を中心として、時に「大脳基底核」、網膜神経細胞、末梢神経などの変性を合併する一群の脳疾患だ。運動失調や記憶・認知障害を伴い、発症から10~20年で死亡してしまう。欧米では10万人あたり2人の確率で起こる代表的な神経変性疾患で、「常染色体優性」、「常染色体劣性」などの形式を取る「遺伝性脊髄小脳失調症」と、家族歴のはっきりしない弧発例がある。
原因タンパク質として「変異型Ataxin1」が特定されており、その遺伝子内部にあるグルタミンリピートの異常伸長により起こる。それゆえ、「ハンチントン病」や「球脊髄性筋萎縮症」などと共に「ポリグルタミン病」と呼ばれ、共通の病態を持つという。しかし、それがどのような分子メカニズムで病態を引き起こすのかについては、未解明な部分も多い。そのため、患者の症状改善や寿命延長のできるような有効な治療法はまだ確立されていないのが現状である。
そこで、岡澤教授らの研究チームが今回注目したのが、神経変性疾患における「DNA損傷修復機構」だ。DNAの損傷は、細胞内における正常な代謝の過程でも1細胞につき1日あたり5万~50万回の頻度で発生し、またさまざまな要因(紫外線、放射線、活性酸素などなど)によりその発生頻度が大きく押し上げられることもある。これが修復されずに残ると、細胞の機能や生存に影響を及ぼし、「アポトーシス(プログラム細胞死)」する場合もあれば、がん化してしまい、その個体の生命そのものを脅かすこともあるというわけだ。
これまでにハンチントン病やSCA1ではDNA損傷修復機構が機能しておらず、その結果、DNA損傷が症状をひどくしていることが報告されている。さらに、近年ではアルツハイマー病においても、脳活動依存性のDNA損傷が増えることが報告されており、DNA損傷とその修復は神経変性疾患の共通病態として注目を浴びているところだ。しかし、SCA1において数あるDNA損傷修復のメカニズムの内のどれが重要で、またDNA修復因子の中で病態への影響の大きい遺伝子が何であるか、といった詳細な分子メカニズムは解明されていなかったのである。
今回の研究では、遺伝学的にデータの豊富なショウジョウバエをモデル動物とし、「バイオインフォマティクス」のテクニックの1つである関連性の高い遺伝子同士を拾い出すネットワーク解析を応用することで、SCA1のDNA損傷に重要な役割を果たす「RpA1(Replication protein1)」と「Chk1(Check point kinase1)」の2つの遺伝子が発見された。
RpA1はpa2、Rpa3と共に「ヘテロ3量体」を形成し、1本鎖DNAと結合する。この複合体は、DNAの複製や修復において必須の役割を担っており、その機能進化的に保存されている。またChk1は、細胞周期を制御するために必須のリン酸化酵素だ。DNA損傷に反応して細胞周期を一時的に停止する"チェックポイント機構"を担う。
なおバイオインフォマティクスとは、コンピュータなどを用い、膨大な情報量を持ったデータベースの中から意味のある情報を取り出そうとする学問の1分野のことをいう。
ショウジョウバエは体が極めて小さく寿命もほ乳類やげっ歯類と比較して短いことなどから(平均5週間程度)、多数の遺伝子の効果を1度に探索することに適している。今回、岡澤教授らの用いたSCA1モデルショウジョウバエは、平均3週間とさらに寿命が短く、この疾患モデルバエにDNA修復関連遺伝子を発現するショウジョウバエライブラリーを掛け合わせることで、多くのDNA修復遺伝子の病態に対する影響がスクリーニングされた。その結果、8個の遺伝子が寿命を回復することが認められ(画像1)、一方で、寿命をさらに短くする遺伝子も複数が見つかった(画像2)。
さらに、今回新たな手法として、「タンパク質間相互作用データベース」やシステムズバイオロジーを利用して、寿命を延長する遺伝子や短縮する遺伝子がそれぞれどのような病態のネットワークを形成しているかが調べられた。すると、寿命を延長する遺伝子では複数のDNA損傷修復機構が機能しており、短縮する遺伝子ではDNA損傷シグナルを活性化していることが明らかとなった。そして、それぞれのネットワークにおいて「RpA1(延長する遺伝子)」と「Chk1(短縮する遺伝子)」が中心的な役割を果たしていることが推定されたのである(画像3・4)。
さらに調べると、RpA1はDNA複製を介したDNA二重鎖切断の修復に関わることが判明した。さらに、SCA1モデルマウスの神経細胞において、RpA1を補充することでDNA複製によるDNA損傷修復を促進することが明らかとなった。これらの結果から、モデルマウスにおいても、障害のある神経細胞を回復させるためには、「DNA複製によるDNA損傷修復」を活用することが有効であると予想されるという。一方、Chk1はこれらのDNA損傷修復の不全によって引き起こされる「細胞障害性シグナル」を仲介していると考えられた。
RpA1を過剰に発現させると、疾患モデルショウジョウバエの神経細胞におけるDNA損傷を抑制しており、RpA1(画像5)の過剰発現あるいはChk1阻害剤はSCA1モデルショウジョウバエの寿命を顕著に延長することが確かめられたのである。
|
|
|
|
画像5(左):RpA1によるDNA損傷レベルの回復。野生型(左)に比べ、SCA1モデル(中)ではDNA損傷が亢進している。ここにRpA1を過剰発現させるとDNA損傷レベルは低下し、野生型に近づいた(右)。 画像6(右):Chk1阻害剤による寿命の回復。SCA1モデル(黒菱)に対し、Chk1阻害剤を投与すると(青丸)寿命の延長効果があった |
|
今回の研究では、SCA1病態におけるDNA損傷の原因としてRpA1の機能が阻害されることによることを明らかにし、また、Chk1阻害剤により治療効果があることも示された形だ。これらの成果は、遺伝子導入や薬剤投与によるヒト疾患患者を対象とした分子標的治療の開発につながるものと考えられるという。
また、病態遺伝子ネットワークの推定に今回用いた新手法が適していることを示せた点も今回の成果の1つだといえる。これまでに、生体内スクリーニングとバイオインフォマティクスの融合により神経変性疾患の分子メカニズムを解明した研究はなく、今後同様の手法を用いることで多くの変性疾患の病態解明を促進することも期待されるとしている。