京都大学は10月25日、一酸化窒素(NO)を光により自在に取り出すことが可能な「多孔性構造体」の開発し、さらに同材料を細胞培養基板に埋め込むことで、細胞の狙った場所をNOで刺激することに成功したと発表した。
成果は、京大 物質-細胞統合システム拠点(iCeMS)拠点長の北川進教授、同・古川修平准教授、同・ステファン・ディーリング助教、同・亀井謙一郎助教らの研究チームによるもの。研究の詳細な内容は、10月25日付けで英オンライン科学誌「Nature Communications」に掲載された。
NOは、自動車の排気ガスや光化学スモッグなどに関連し(NOx)、公害のイメージが強い、毒性のある気体だ。しかし、ヒトの体の中でも生成されており、細胞間のコミュニケーションを調整する分子、つまり「情報伝達物質」として知られている。特に1987年にNOが血圧に応じて血管を弛緩する主要な因子、「血管内由来弛緩因子(EDRF)」として同定されて以来、中枢神経系などにおける情報伝達作用などさまざまな生理的作用を持っていることが明らかとなってきた。
例えば、爆発性の高い物質としてよく知られていると同時に、狭心症などの治療に血管拡張薬として使用されているニトログリセリンは、体内で加水分解・還元反応を介してNOになることによって、その効果を示す。
その一方で、一酸化窒素は前述したように公害と関連し、毒性を持つガスとしても知られており、高濃度のNOを生物が吸収すると死に至ってしまう。細胞に対しても同様で、免疫細胞の1種である「マクロファージ」は細菌やバクテリアなどの外敵を殺すために、NOを放出するシステムを持っている。このようにNOは生物学にはもちろん医学的にも重要な分子であることから、その生物学的機能の発見に対して1998年にノーベル医学・生理学賞が授与されたというわけだ。
しかし、細胞内でどのような分子的メカニズムでNOが作用しているのかというと、実はいまだその仕組みは完全には解明されていない。その理由には、NOはガス状分子であるため同じ場所に留まることができず(拡散が速く)、取り扱いが困難なことが挙げられる。そこで、細胞内という小さな領域で、NOの濃度を自在に制御できる材料の開発が待ち望まれてきたというわけだ。
NOをはじめとする各種ガス分子を閉じ込められる物質として、近年になって注目を集めているのが、「多孔性金属錯体(PCPもしくはMOIF)」と呼ばれる金属イオンと有機物が向上に組み上がった、均一なナノサイズの細孔を持つ多孔性構造体である。
この結晶性化合物は、細孔のサイズや特性を変えることができるため、目的に応じた設計が可能であり、さまざまな分子(特にガス分子)をその細孔中に効率的に取り込むことが可能だ。その性質を活かして、エネルギー燃料であるメタンや水素ガスの大量吸蔵や分離、二酸化炭素の大気中からの分離などへの応用が期待されており、高い注目を集めているのである。
これらの機能は「ガスが細孔の中に入ってくる」現象であり、これまではこの制御を行う研究が主になされてきた。研究チームは一酸化窒素(NO)の生理学的役割の概要、このPCPにNOを取り込ませ、必要な時に必要なだけ取り出すことができる材料が開発できれば、細胞内におけるNOの濃度調整ができるのではないかと考察。ただし、そのためには「ガスが細孔から出てくる」というこれまでとはまったく逆の現象を制御する必要があった。そこで研究チームは今回、それを可能とする新しいPCPの合成に取り組んだのである。
今回の研究では、PCPに閉じ込めたNOを光照射によってのみ取り出すことに成功し、さらに細胞培養基板にPCP結晶を埋め込むことで、レーザー光で狙った場所でのみNOを取り出し、生きた細胞に取り込むことに成功した。
細胞実験を行う室温・大気圧中ではNOはガス状の分子であるため、PCPの細孔で単純に取り込むことはできず、PCPと強い化学結合を持たせる必要がある。そこで研究チームは、NOをニトロ基(-NO2)として共有結合的にPCPの骨格に固定する手法を採り入れた。
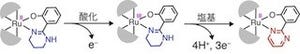
具体的には、「イミダゾール」と呼ばれるPCPを構築する有機化合物にニトロ基を導入した「ニトロイミダゾール」を用いて亜鉛イオンと共に反応させることで、画像3に示されているようなPCPが合成されたのである。このPCPは「NOF(Nitric Oxide Framework)-1」と命名された。
このNOF-1に紫外光を当てると、ニトロ基が分解され、NOが放出されることが確認され、実際に紫外光の照射を止めると、数秒の内にNOの放出はなくなり、光のON/OFFでNOの放出を制御できることが判明。さらに時間あたりの放出量は、当てる光の強度を変えることで調整できることも確認された。
次にNOF-1を細胞実験に応用するため、研究チームは画像4に示されているような細胞培養基板を作成。まず、ガラス基板上にNOF-1結晶がコーティングされた後、生体適合性の高いシリコンゴム「PDMS」がさらに上からコーティングされた。このPDMSはガス透過性が高いことでも知られており、NOF-1結晶から放出されたNOガスを妨げることなく、速やかにPDMS膜を透過することができるのである。細胞培養を行うため、このNOF-1を用いた細胞培養基版は70%エタノールにて滅菌された後、細胞接着・増殖を促すマトリゲルがコーティングされた。
この細胞培養基板中に埋め込まれたNOF-1結晶にのみ、顕微鏡下でレーザーを当てることで局所的にNOを放出することが可能だ。また、この基板上にNOと反応すると緑色に発色する蛍光分子を入れた「HEK293細胞」が培養された。これにより、画像5に示されているように、狙った場所にレーザー光を当てることで、自在にNOが放出され、局所的に細胞刺激を行うことができるまったく新しい手法の開発に成功したのである。
画像5は、細胞を用いた実験概要。細胞にはNOと反応すると蛍光を発する指示薬が導入されている。NOと反応した細胞のみ蛍光を発するので、局所的なNO放出、および細胞刺激を観察することが可能だ。
今回開発された手法によって光によりNOを取り出すことができるPCPが開発され、それをさらに培養基板へ埋め込むことで、実際に細胞生物学へ応用することが可能になった。この細胞培養基板は、ほかにも数多くの細胞種(ES/iPS細胞、神経細胞など)の培養・刺激試験への応用が可能だという。今後は、さまざまな細胞へ応用することで、いまだ謎のままであるNOの細胞内での役割を解明していく予定としている。