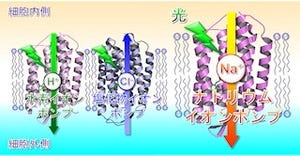
東京大学は10月3日、デンマーク・オルフス大学との共同研究により、理化学研究所が所有し高輝度光科学研究センターが運用する大型放射光施設「SPring-8」の共用ビームライン「BL41XU」を用いたX線結晶解析によって、2009年に発表したカリウム結合状態の構造に加え、今回、ナトリウムを結合した状態のナトリウムチャネルの結晶構造を2.8Åという高分解能で決定することに成功し、ナトリウムチャネルがどのようにして、細胞内により多く存在するカリウムではなく、ナトリウムを選択的に結合し運搬するのか、この目的のためにどのような特異的な構造を備えているのかといったことや、ナトリウムチャネルの働きを止めてしまう抗生物質オリゴマイシンとの結合様式を解明したと発表した。
成果は、東大 分子細胞生物学研究所附属 高難度タンパク質立体構造解析センターの豊島近 教授(同センター長兼任)、同・金井隆太助教、同・小川治夫准教授、オルフス大学のBente Vilsen教授、同・Flemming Cornelius准教授らの国際共同研究チームによるもの。研究の詳細な内容は、10月2日付けで英科学誌「Nature」オンライン版に掲載された。
ナトリウムチャネルは生物の体内におけるエネルギー通貨といわれる「ATP(アデノシン三リン酸)」の化学エネルギーを利用し、細胞内から細胞外へナトリウムイオンを汲み出し、同時にカリウムイオンを汲み入れるイオンチャネル(イオンポンプ)だ。すべての動物細胞に発現しており、神経興奮や心臓の拍動といった生命活動の基盤を作る極めて重要な大型の膜タンパク質である。
ナトリウムチャネルは、ATP1個当たり3個のナトリウムイオンを細胞内から細胞外へ汲み出し、同時に細胞内へ2個のカリウムイオンを汲み入れている(対向輸送する)。カリウムイオンがなくても働くので、本質的にナトリウムチャネルだ。また、ATPを分解する酵素「ATPase」でもある。ナトリウムチャネルが生物にとってどれだけ重要かということは、1997年度のノーベル化学賞が発見者のJ.C.Skou博士(デンマーク)に与えられたことからもわかるはずだ。
類縁のチャネルタンパク質としては、胃の酸性を維持する水素イオンチャネルや、筋肉の弛緩の担い手であり構造研究が最も進んでいるカルシウムチャネルがある。チャネルタンパク質が働くことで、細胞の内外でイオンの濃度に差が生じ、この濃度差が、神経興奮や心臓の拍動といった生命活動の基盤となるのだ。実際、脳で消費されるエネルギーの50%以上は、ナトリウムチャネルによって消費されるほど重要なタンパク質である。
カリウムイオンを結合した状態におけるナトリウムチャネルの構造の決定には2009年になされているが、実はその名の由来であるナトリウムイオンを結合した状態の構造は未決定であった。それが今回の成果によって、どのようにしてカリウムではなくナトリウムを選択的に結合し運搬できるのか、そのためにどのような特異的構造が備わっているのかなどが明らかになった。
また、圧倒的に構造解析が進んでいるカルシウムチャネルと比較することによって、2つのチャネルタンパク質はよく似たアミノ酸配列を持ち、また、カルシウムイオンとナトリウムイオンはほぼ同じ大きさ(半径0.99Åと0.95Å)を持つにも関わらず、ナトリウムチャネルがなぜナトリウムを非常に効率よく選択できるのかという理由も明らかになった。
ナトリウムチャネルは200年以上処方されてきた強心剤「ジギタリス」の標的タンパク質であり、高血圧やがん、多くの神経病変にも深く関わっている。また、腎臓における水とナトリウムの再吸収も極めて重要な働きであり、高血圧とも結びつきが深い(実際、今回の研究では特にナトリウムチャネルの密度が高いブタの腎臓から精製したものが用いられた)。
このチャネルによって形成される細胞の内側と外側のナトリウムイオンの濃度差は多くの膜輸送体の駆動力ともなるため、このチャネルの活動は多様な制御を受けており、その異常によって、細胞の体積やpH、小腸における糖やアミノ酸の吸収など、一見このチャネルとは関係のないような機能も多大な影響を受けてしまう。
そのため、ナトリウムチャネルは多くの病変に対する薬剤の標的となり得るものであり、がんや高血圧の薬剤として臨床試験段階にあるものも幾つも存在する。今回の成果はただちに病気の治療に結びつくものではないが、このチャネルタンパク質を制御する薬剤の開発に対し重要な基盤を与えるものであるとした。