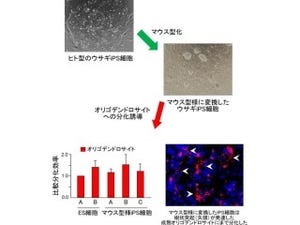
東京理科大学、慶應義塾大学(慶応大)、オーガンテクノロジーズの3者は10月2日、マウス胎仔の「涙腺原基」を由来とする細胞を用いて再生涙腺原基を作り出し、涙腺の喪失部位に移植・生着させることにより、機能的な涙腺の再生に成功したと共同で発表した(画像1)。
成果は、東京理科大学・総合研究機構の辻孝 教授(オーガンテクノロジーズ取締役兼任)、慶応大医学部 眼科学教室の坪田一男教授、同・平山雅敏助教らの共同研究チームによるもの。研究の詳細な内容は、10月1日付けで英オンライン科学誌「Nature Communications」に掲載された。
涙腺は涙液を眼表面に分泌することにより、眼表面を保護する役割を担う。涙腺は、歯や毛、唾液腺といったほかの外胚葉性器官と同様、胎児期に起こる上皮・間葉相互作用により誘導される「器官原基(涙腺原基)」から発生する。成熟した涙腺は、分泌を担当する「腺房」、その周囲を取り囲み分泌物をしぼり出す「筋上皮細胞」、分泌物を送り出す「導管」からなり、神経機能と連携することで、高効率の涙液分泌システムを構成している。眼表面上の涙液は、涙腺から分泌された水分やタンパク質と、「マイボーム腺(マウスにおいてはハーダー腺)」から分泌された脂質からなっており、涙液の機能である眼表面の湿潤、洗浄といった作用を果たしている(画像2・3)。
涙腺の機能低下により涙液が不足した状態がドライアイだ。涙液の減少により、眼表面の細胞が障害され、視機能の低下や眼の不快感などを引き起こす。ドライアイの原因には、「シェーグレン症候群」や「スティーブンスジョンソン症候群」といった内科的疾患から起きるもののほかに、加齢やパソコン作業などの環境的要因などがある。
日本のドライアイ患者は800万人以上、さらにドライアイ予備軍まで含めるとその数は2200万人にも達するという(ドライアイ研究会報告)。さらに、高度情報化社会である現代の生活において、患者数は増加傾向であるため、その治療の需要が高まっている。ドライアイに対する現状の治療は、人工涙液点眼を主とした対症療法が中心だ。そのため、涙腺機能の回復を実現するために、これまで幹細胞移入療法を目指した涙腺の組織幹細胞研究が進められているものの、未だに臨床応用への道筋は立っていない。
そこで研究チームが目指したのが、次世代の再生医療としてさまざまな分野で基礎研究が進められている「臓器置換再生医療」による涙腺の再生だ。研究チームはこれまでの研究により、生体外における細胞操作により単一化した上皮細胞と間葉細胞から共通発生メカニズムである上皮・間葉相互作用を誘導し、臓器・器官の基となる器官原基を人為的に再生する「器官原基法」を開発済みである。また同法により「歯」や「毛」などの外胚葉性器官の再生可能性も実証済みだ。これらの研究成果から、再生器官原基による器官再生のコンセプトが実証され、幅広い臓器・器官への技術応用が期待されている(画像4)。そこで研究チームは今回、涙腺再生医療の実現を目指して、涙腺再生の技術開発を進めたというわけだ。
涙腺は、冒頭で述べたように胎生期における上皮・間葉相互作用から誘導された涙腺原基から発達する腺房や導管なる腺構造を持ち、神経などの周囲組織と連携する機能的な涙腺へと成長する。そこで今回の研究では、マウス涙腺原基由来の上皮・間葉細胞から器官原基法により涙腺の基となる再生涙腺原基が作製され、涙腺機能が障害されたモデルマウスへ移植することで、機能的な涙腺を再生することが可能であるかどうかの解析が行われた。さらに今回の研究では、マウスにおいて眼表面に脂質を分泌するハーダー腺を再生することが可能であるかの解析も併せて行われている(画像5)。
器官原基法により人為的に作成された再生涙腺原基は、成長して分泌腺特有の分岐構造が認められたことから、再生涙腺原基の作製が可能であることが確認された。同様の方法でマウスハーダー腺原基も再生可能であることも判明(画像6)。この再生原基がマウスに移植されたところ、再生涙腺・再生ハーダー腺が高い頻度で生着したのである(画像7)。さらに、レシピエント導管(画像8の▽)から注入された色素は漏れることなく再生涙腺に到達し、導管連結が確認された(画像8)。
|
|
|
|
|
再生涙腺・ハーダー腺の移植と生着。画像6(左):発生した再生涙腺、ハーダー腺。スケールバーは100μm。画像7(中):移植により生着した再生涙腺(上)・再生ハーダー腺(下)。スケールバーは500μm。画像8(右):再生涙腺とレシピエントの導管連結。スケールバーは500μm |
||
涙腺の組織は、腺房とそれを取り囲む筋上皮細胞、導管、神経などの周辺組織が立体的に配置された構造であり、効率的な涙液分泌を可能にする。再生涙腺・ハーダー腺は、このような立体的組織構造と神経線維侵入を再現していることが明らかとなった(画像9)。さらに、再生涙腺・ハーダー腺の腺房は、それぞれラクトフェリン、脂質を含むことが示され、分泌物をつくることが可能であることが示された(画像10・11)。
|
|
|
|
|
再生涙腺・ハーダー腺の組織構造の解析。画像9(左):再生涙腺・ハーダー腺の腺房(左列)。腺房周囲には筋上皮細胞(右列、赤色)、神経線維が確認された(右列、緑色)。画像10(中):再生涙腺の腺房にはラクトフェリン(茶色)が認められた。画像11(右):再生ハーダー腺の腺房には脂質(ピンク色)が認められた。スケールバーはすべて50μm |
||
涙腺は、眼表面を外界から守るために、眼表面における刺激を知覚し涙液分泌を行うことが必要だ(画像12)。今回の研究において、再生涙腺・ハーダー腺は、眼表面の冷温分泌刺激によりそれぞれ透明な涙液、白く濁った涙液を分泌することが確認された(画像13)。さらに、再生涙腺における涙液分泌量は、正常涙腺と同等に増加することも判明(画像14)。また、涙液の脂質濃度を調べると、再生ハーダー腺からの涙液には脂質が多く含まれていることが確認されたのである(画像15)。このことから、再生涙腺はレシピエントの中枢神経システムとの接続を介した分泌機能を再生していることが示されたというわけだ。
|
|
|
|
再生涙腺の涙液分泌能の解析。画像12(左):知覚された眼表面刺激は、中枢神経系を通り涙腺の分泌を刺激する。画像13(右):分泌刺激後のマウス眼表面 |
|
|
|
|
|
再生涙腺の涙液分泌能の解析。画像14(左):メントールによる眼表面への冷温刺激後の涙液分泌量(灰色:正常涙腺、黒色:再生涙腺)。画像15(右):涙液中の脂質濃度解析 |
|
再生涙腺が眼表面保護機能を発揮することは、機能的な涙腺の再生において最も重要なことだ。再生涙腺を移植したマウスにおいて、移植後30日の角膜上皮の障害面積は、同時期に処置した眼窩外涙腺摘出マウスと比べて改善しており、正常マウスと同等の健常な眼表面を維持していることが明らかとなった(画像16)。
また、長期にドライアイが続くと角膜上皮細胞が脱落し角膜上皮の厚みは薄くなる。移植後60日の時点において角膜上皮の厚みが調べられ、すると再生涙腺移植マウスは正常マウスと同等の厚みを保つことができることが確認された(画像17)。このことから、再生涙腺による眼表面保護は可能であることが確かめられたのである。
以上の研究成果から、器官形成能を持つ上皮細胞・間葉細胞から再生した涙腺原基を作り出し、涙腺の喪失部位に移植することにより、機能的な涙腺を再生する「涙腺再生医療」のコンセプトが世界で初めて実証された形だ。また、もう1つの涙液の重要な構成脂質の分泌器官であるハーダー腺の再生も実証され、脂質分泌腺再生の実現可能性が示されたといえよう。
今後、今回の技術の臨床応用化に向けて、iPS細胞などの臨床において利用可能な幹細胞を用いた涙腺再生の技術開発が課題として考えられているという。研究チームは、今年度より科学技術振興機構により「再生医療実現拠点ネットワーク事業再生医療実現ネットワークプログラム、技術開発個別課題」として、研究課題「歯・外分泌腺などの頭部外胚葉器官の上皮・間葉相互作用制御による立体形成技術の開発」(平成25~30年度、代表研究機関:東京理科大学)が採択されており、この一環として研究を進めていくとしている。