東京医科歯科大学(TMDU)、秋田大学、科学技術振興機構(JST)の3者は9月13日、白血球の1種で無数の突起を持つ外見が特徴的な「樹状細胞」による、赤血球や白血球を食べる現象である「血球貪食」が、過剰な免疫反応を抑制する仕組みであることを新たに発見したと共同で発表した。
成果は、TMDU 難治疾患研究所の樗木俊聡 教授、秋田大大学院 医学系研究科の澤田賢一教授らの研究チームによるもの。研究はJST課題達成型基礎研究の一環として行われ、詳細な内容は米国東部時間9月12日付けで米科学誌「Immunity」オンライン速報版に掲載された。
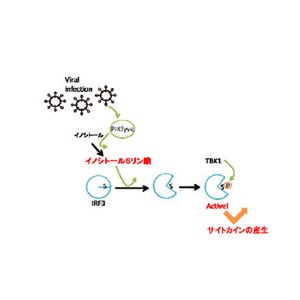
免疫反応は、病原体を排除することで宿主を防衛すると同時に組織を傷害する、いわば諸刃の剣だ。感染や炎症が起こると樹状細胞は、「Toll様受容体(TLR)」を初めとするセンサで病原体の特徴を認識し、獲得免疫系を活性化して病原体を排除する仕組みを持つ。
しかし、活性化された免疫反応、特にサイトカイン、化学伝達物質、ウィルスを排除する「キラーT細胞」などは、病原体の排除に役立つと同時に本来は守るべき組織も傷害してしまう。従って、免疫反応には病原体排除と組織傷害のバランスを調節・維持するための仕組みが必要で、激しい免疫反応ほどそのバランスを適度に調節する仕組みの重要性が増すというわけだ。しかし、激しい免疫反応時のバランス調節機構に関してはよくわかっていない。
激しい炎症時には、樹状細胞やマクロファージなどの貪食細胞による血球細胞の貪食が起こる。さらにいくつかの診断基準を満たすと、「ヒト血球貪食症候群(HPS:Hemophagocytic Syndrome)」と呼ばれる疾病だ。HPSは発熱、脾腫、血球減少、高トリグリセライド血症・低フィブリノゲン血症、血球貪食を特徴とし、適切な治療が施されないと死に至ることもある。先天的な原因で発症する一次性HPSと、感染症や自己免疫疾患に付随して発症する二次性HPSに分類され、これまで、血球貪食は激しい炎症の1指標として位置づけられていた。この血球貪食の仕組みもまたまだよくわかっていないことの1つである。
研究チームは今回、炎症時における血球細胞の貪食の仕組みを明らかにするため、代表的なTLRが認識するリガンド(受容体に特異的に結合する物質)である「CpG」(微生物に多く見られるDNA配列)あるいは「poly I:C」(ウィルスの構成成分に類似の合成RNA)を高濃度で野生型マウスに投与し、激しい炎症を誘導した。その結果、骨髄、脾臓、末梢血などで血球貪食現象が観察されたのである(画像1)。
貪食される細胞は主に未熟な有核赤血球だったが、脱核した成熟赤血球も混在していた。また、貪食細胞が「単球由来樹状細胞(単球由来DC)」であることもわかった。なお、単球とは「単核白血球」とも呼ばれる白血球の1種で、骨髄で作られ血管外ではマクロファージに分化する。異物の貪食、分解能を持ち、激しい炎症時には樹状細胞にも分化するという特徴も持つ。
ヒトでは、EBウィルス、サイトメガロウィルス、HIVなどの慢性感染症でHPSが観察される。そこで、マウスに慢性感染する「リンパ球性脈絡髄膜炎ウィルスクローン13株(LCMV C13:Lymphocytic Choriomeningitis Virus Clone13)」を感染させたところ、血球貪食が効率よく誘導されることが確認された(画像2)。
そこで研究チームは、これらのマウス血球貪食症候群モデルを用いて、血球貪食機構を詳細に調査。高濃度TLRリガンドあるいはLCMV C13によって赤血球系細胞にアポトーシス(プログラム細胞死)が起こり、「フォスファチジルセリン(PS)」が膜表面に露出して、単球由来DC上のPS受容体に結合し、貪食されていることがわかったのである。
|
|
|
|
単球由来DCによる血球貪食。野生型マウスにCpG(200μg)あるいはLCMV C13(2x106pfu)投与後、骨髄から血球貪食している単球を精製してDiff-Quick染色した画像。表面に接着している、あるいは細胞内に取り込まれている赤血球系細胞が観察される。画像1(左):CpG。画像2:LCMV C13 |
|
また単球由来DCは血球を貪食すると、血清中に「インターロイキン(IL)-10」や「TGF-β」といった「免疫抑制性サイトカイン」(細胞間でやり取りされる多様な生理活性を持つタンパク質の1種)を産生することも確認された(画像3・4)。
|
|
|
|
血球貪食に依存したIL-10(画像3(左))、TGF-β1(画像4)の産生。野生型マウスにLCMV C13(2x106pfu)を感染させるとIL-10やTGF-β1が産生されるが、PS受容体に対する抗体を投与して血球貪食を抑制すると、それらサイトカインの再生が有意に低下した |
|
続いて研究チームは、この血球貪食によって産生されるIL-10の免疫学的意義を明らかにするため、単球由来DCがIL-10を産生できないマウスを用いてその血球貪食についての解析を実施。そして同マウスにLCMV C13を感染させたところ、ウィルスを排除するキラーT細胞の誘導が促進され、LCMV C13の排除が亢進したが、一方、キラーT細胞によって肝傷害が重症化して半数以上のマウスが死亡した(画像5・6)。このことから、血球貪食現象はIL-10の産生を介して過剰な免疫応答を抑制していること、特に重篤な感染症において個体の死を回避する「免疫寛容」(ある抗原に対する免疫応答が失われている状態で、自己の持つ抗原に対してはこの状態が保たれている)システムとして非常に重要であることが明らかになったのである(画像7)。
今回、二次性HPSなどで観察される血球貪食は、感染などによりアポトーシスを起こした赤血球系細胞などが、単球由来DCを初めとする貪食細胞によって貪食される現象であることがわかった形だ。また、単球由来DCは血球貪食によって免疫応答を抑制させるサイトカインを産生させ、過剰な免疫反応を抑えることで個体を死から守っていることも確認された。
そしてこれまで血球貪食はHPSやほかの激しい炎症状態の1指標とされてきたが、今回の研究成果により、血球貪食が炎症抑制反応のバイオマーカーになり得る可能性があることもわかった形だ。また、血球貪食は激しい炎症状態を抑えることで自らの死を防ぐ代わりに病原体の排除を見送る、宿主~病原体間の共生戦略ととらえることもできるという。
さらに今回の研究成果は、慢性感染成立における新たな生物学的視点を提供するものであり、免疫細胞の暴走など、過剰な免疫反応を伴う感染症・自己免疫病に対する新たな診断法・治療法の開発が期待できるものだとしている。