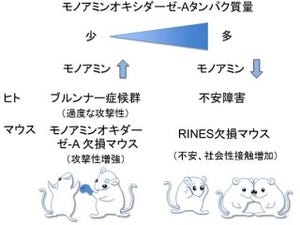
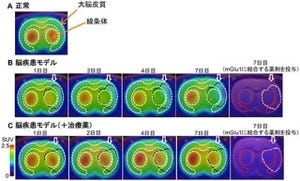
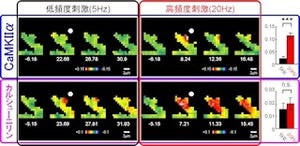
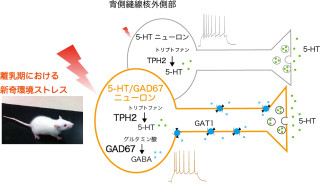
沖縄科学技術大学院大学(OIST)は8月29日、生化学と電気生理学の手法を組み合わせ、酵素「Rhoキナーゼ」が神経細胞間の情報伝達を調節する重要な分子であることを発見したと発表した。
成果は、OIST 細胞分子シナプス機能ユニットのザカリ・タウフィック研究員、同・江口工学研究員、同・高橋智幸教授らの研究チームによるもの。研究の詳細な内容は、7月17日付けで「Journal of Neuroscience」に掲載された。
神経細胞間の接合部分に目を向けると、神経細胞から神経細胞へ神経伝達物質をやり取りするための「シナプス」と呼ばれる部位が存在している(画像1)。伝達物質を放出する側を「シナプス前末端」、受け取る側を「シナプス後膜」という。そしてシナプス前末端には伝達物質を詰め込んだ「シナプス小胞」と呼ばれる直径50ナノメートルほどの袋が格納されている。
電気信号がシナプス前末端まで到達すると、シナプス小胞が「前末端膜」に融合し、中の伝達物質を外へと放出、つまり「エキソサイトーシス」する。シナプス後膜は伝達物質を受容体で受け取り、電気信号へと変換し情報が受け渡される仕組みだ。シナプス前末端膜に融合した小胞膜はその後末端内に取り込まれ、つまり「エンドサイトーシス」され、再びシナプス小胞としてリサイクルされるのである。
今回研究チームが着目したのは、このエンドサイトーシスに関わる謎の分子だ。昨年の江口研究員による成果で、エンドサイトーシスがシナプス後膜から放出された一酸化窒素によって加速することや、酵素「cGMP依存性プロテインキナーゼ(PKG)」と脂質「ホスファチジルイノシトール4,5-二リン酸(PIP2)」が関与していることを特定していたが、PKGとPIP2の間の反応をつなぐ分子は未発見のままだった(画像2)。
その未発見の分子を見つけるには、電気生理学の手法だけでは難しいと感じていた江口研究員は、生化学を専門とするタウフィック研究員とチームを組むことで、今回の発見に至ったというわけである。
タウフィック研究員は多くの候補の中で、最も有力だと考えられるRhoキナーゼをターゲットとして絞り込み、ラットの脳試料からシナプスを含む細胞膜成分を取り出し(画像3)、質量分析装置を使ってそこに含まれるPIP2分子の量を計測した。
そして、Rhoキナーゼの働きを抑える阻害剤を加えた時にPIP2が減り、逆に活性剤によってPIP2が増えることが確認されたのである。また、以前の報告でPKG阻害剤がPIP2を減らすことが確認されていたことから、Rhoキナーゼ活性剤がこの効果を打ち消すことも解明された。Rhoキナーゼが確かにPKGとPIP2をつなぐ物質であることが突き止められたのである。
しかし、この反応がいつどこで起こっているのか、また神経伝達にどのように働いているのかは、この手法だけでははっきりしなかった。そこで江口研究員は、Rhoキナーゼの働きを抑えた時と活性化した時とで、シナプス前末端で起きるエンドサイトーシスの速さに違いがあるのかかどうかを、「膜容量測定法」と呼ばれる電気生理学的手法で調べたのである(画像4・5)。
その結果、抑制剤によってRhoキナーゼの働きを阻害するとエンドサイトーシスは遅くなることが確認された。またPKG阻害剤によるエンドサイトーシスの減速は、Rhoキナーゼの活性剤によって打ち消されることも確認され、RhoキナーゼがPKGとPIP2の間の反応を仲介し、シナプス小胞膜のエンドサイトーシスを制御していることが明らかにされたというわけである。
高橋教授は「これほど詳細に詰めが行われた研究はめったにありません」と述べており、これまでの多くの研究は分子の存在がわかっても、その分子の振る舞いを時空間的に正しく説明できるものはあまりなかったという。今回の生化学と電気生理学を併せた研究手法は、神経伝達の研究を分子と現象の関係を明らかにするレベルへ飛躍的に引き上げた形だ。将来、パーキンソン病やアルツハイマー病などの神経伝達に関わる病気の理解や治療に役立つことが期待されるとしている。