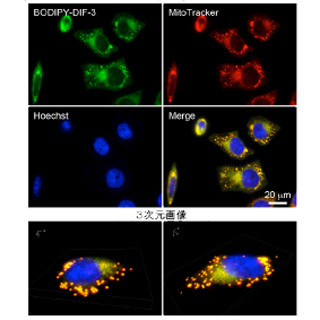
東京大学(東大)は、肺がんの転移を抑制するブレーキ因子(DSCR-1)、ならびに転移を加速させるアクセル因子(Angiopoietin-2:Ang-2)を発見し、それらを制御することで血管内皮の恒常性を保ちつつ、がん細胞が入ったあとでも肺への転移を効率よく駆逐することに成功したと発表した。
同成果は同大先端科学技術研究センターの南敬 特任教授、米国ペンシルバニア大学がん研究所 Sandra Ryeom博士らによるもの。詳細は「Cell Reports」に掲載された。
がんは、酸素・栄養供給源や通路となる血管を新たに作りだし、そこから栄養を得ることで増殖や転移を行っているため、その血管構築(血管新生)を止める薬剤(VEGF中和抗体:アバスチン)が近年、がん治療目的に用いられるようになっている。しかし、正常血管にも副作用があるという懸念もあり、血管内皮の恒常性を正常に保ちつつ、がんの転移を防ぐ薬剤の開発が求められるようになっている。
研究グループは、炎症・凝固因子などの刺激で最も強く誘導されるダウン症因子(Down syndrome critical region-1:DSCR-1)が、自らの活性化シグナルを止める自己終息ブレーキ因子であることに着目し、研究を行ってきており、これまでの研究から、DSCR-1は神経ではダウン症発症にも寄与する一方、血管内皮細胞では炎症・腫瘍環境下で防護的に作用していること、さらに、ダウン症患者が疫学的に固形がんにかかりにくいのは、がん発症のブレーキ因子として DSCR-1が寄与しているためであることなどを明らかにしてきている。
今回の研究では、DSCR-1モデルマウスを使ってがんの転移への影響の解析を実施。その結果、DSCR-1を多く発現するマウスでは肺へのがん転移が止まるのに対し、DSCR-1を欠いたマウスでは肺がん転移が早期に成立することを見出したという。
また、この転移は原発腫瘍の大きさに関係なく、肺におけるVEGF量と相関して転移が進んでいることも確認したほか、転移モデルマウスの肺血管内皮では、がんが転移する以前にVEGFの刺激が増え、転移先の肺でがんが転移する環境にあらかじめ変化していたが、この変化は、肺にがんが転移した患者の臨床データからも確認することができたという。
さらに、VEGF刺激に応じて肺血管内皮ではサイトカイン(Angiopoietin-2:Ang-2)が強く誘導され、がん細胞の転移を誘発していることも発見。Ang-2を止める可溶型のおとり受容体をマウスに安定発現させたところ、がん細胞が入った後でもそれが肺に転移するのを効率良く抑制できることを確認したとするほか、肺がん患者の臨床データにても、肺の原発腫瘍よりも他臓器(胃や大腸)から肺に転移したがん周囲の血管内皮細胞に最も強く発現していることが確認されたとする。
なお、ブレーキ因子であるDSCR-1は内皮細胞の安定性を保ちつつ、異常活性化や病的血管新生のみを防護できるため、副作用の少ない薬剤の開発につながることが期待されると研究グループは説明する。また、アクセル因子であるAng-2を止めることで転移が抑制できることが確認されたことから、患者の肺へ転移したがんを駆逐する薬剤の開発や転移抑制法の確立にもつながることが期待されるとコメントしている。