東北大学は6月13日、蛍光ナノ粒子の「量子ドット」上にウイルス由来のペプチドを8個固層化することで、能動的に細胞内に侵入できるナノロボットとしての性質を付与できることに成功したと発表した。
成果は、東北大病院の鈴木康弘講師らの研究チームによるもの。研究の詳細な内容は、現地時間6月3日付けで米専門誌「Molecular and cellular biology」オンライン版に掲載され、印刷版8月号にも掲載の予定だ。
ナノカプセル内にタンパク質や薬物を封じ込めて、目的とする細胞へ送り届けるドラッグデリバリシステム(DDS)や、さまざまな性質のナノ粒子を目的とするがん細胞などに送り込み、その後に外から物理的な変化を加えて、がん細胞などを破壊するといったナノ粒子を用いた医療技術が注目を浴びている。しかし、細胞は脂質2重膜で包まれており、ナノ粒子を細胞内に侵入させることは容易でない。そこで、効率的にナノ粒子を細胞内に侵入させる技術の開発が求められているのが現状だ。
そこで研究チームは今回、ペプチド「タンパク導入ドメイン」に着目。このタンパク質はヒトを含むさまざまな生体内タンパクに認められる10~20程度のアミノ酸配列で、それをさまざまな高分子化合物に結合させることで細胞内に導入させることが可能だ。ただし、どのような分子機序で細胞内に入るかということと、細胞内導入効率を上げるにはどのように改良したらよいかという2点についてはまだ十分に明らかにされていない。
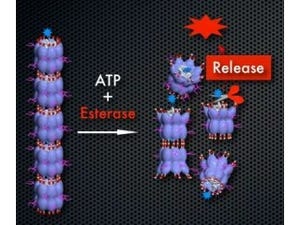
研究チームはHIV-1ウイルス由来のタンパク導入ドメインを結合させた蛍光ナノ粒子である量子ドット(発光性の半導体ナノ粒子で、直径の範囲は1~20nm)を特殊な顕微鏡で観察することで、ナノ粒子の細胞上での運動を詳細に観察し、その細胞内侵入機序の詳細を明らかにした。蛍光ナノ粒子上にHIV-1ウイルス由来の長さ11アミノ酸のタンパク導入ドメインペプチドを8個固層化すると、ナノ粒子は生細胞の表面上で局所刺激を引き起こし、方向性を持って運動する能力を獲得したのである。
さらに、このナノ粒子は局所刺激によって、細胞に対して細胞外の物質を取り込む過程の1つである「エンドサイトーシス」(細胞の表面から膜が細い管状に細胞内に落ち込んで、その管の首の部分がくびれることによって細胞内に細胞表面に吸着した分子を取り込む)を誘導し、細胞表面から細胞内に侵入していく能力を獲得したことが明らかになった。
具体的には、(1)糸状仮足に結合したナノ粒子は、細胞内のモータタンパク質を利用して膜状仮足方向に運搬される。(2)膜状仮足上に結合、もしくは移動したナノ粒子は細胞表面を微小管およびアクトミオシンを介して中心性に運搬される。(3)その後に細胞膜上のマイクロドメインから局所刺激を細胞に引き起こし、エンドサイトーシスを活性化して細胞内に侵入するという仕組みだ。
このことから、タンパク導入ドメインペプチドを多数、固層化すると個々のナノ粒子は局所刺激を引き起こすことで、細胞上でロボットのように働き、細胞表面から細胞内に侵入する性質を獲得することが確認されたのである。
|
|
|
|
|
(左):ナノ粒子が局所刺激によって、エンドサイトーシスで細胞内に侵入する流れの全体図。(中央):とっかかり部分の、糸状仮足に結合したナノ粒子。(右):エンドサイトーシスを活性化して細胞内に侵入するところ |
||
従来型のDDSでは細胞内への取り込みは「受動的」であり、濃度依存性に引き起こされていたために、濃度を一定以上に上昇させることが、細胞内への取り込みに必要であった。しかし、そのために濃度の上昇に伴いさまざまな副作用が起きるというデメリットがあったのである。
今回の発見では個々の粒子がナノロボットとしての性質を獲得し、細胞内へ「能動的」に侵入するために、導入効率がよい。このために血中内濃度を上昇させなくとも、細胞内へ取り込まれ、細胞導入効率の改善と副作用の軽減が期待できるようになるという。
研究チームは今後、同様の手法が、さまざまな性質のナノ粒子、ナノカプセル、高分子化合物、高分子薬物の細胞内導入法として活用されることが考えられ、さまざまながんの治療・診断や再生医療への応用が期待されるとしている。