大阪大学(阪大)は3月21日、白血球「M2マクロファージ」の内、体内のさまざまな抹消組織に存在しているものを「組織常在型M2様マクロファージ(tissue-resident M2-like macrophage)」と命名し、その細胞分化を司る遺伝子として「Tribble1(Trib1)」を発見、さらに同遺伝子を欠損したマウスでは、脂肪組織が萎縮する疾患である「リポディストロフィー」およびそれに起因して発症するメタボリックシンドロームの病態を呈することを証明したと発表した。
成果は、阪大 免疫学フロンティア研究センターの佐藤荘助教と審良静男教授らの研究グループによるもの。研究の詳細な内容は、現地時間3月20日付けで英国科学雑誌「Nature」オンライン版に掲載された。
マクロファージはヒトなどの体内において自然免疫において中心的な役割を果たす存在で、細菌やウイルス感染の際に活性化し、それらを排除するという役割を持つ存在だ。また近年の研究により、寄生虫感染、アレルギー応答、脂肪代謝、創傷治癒およびがんの転移・浸潤などにも寄与している可能性も明らかとなってきている。病気ごとにそれぞれ異なったマクロファージが担当を受け持っているものと考えられており、病原体の感染の際に活性化する細胞集団を「M1マクロファージ」、寄生虫感染などの病気の際に活性化する細胞集団を「M2マクロファージ」という。
しかし、これまでの研究ではマクロファージが実際にどのように生体内で働いているのか、そしてどのようにそれらの細胞は生まれてきているのかについて、実はほとんどわかっていなかった。そこで研究グループは今回、M2マクロファージが生まれてくるメカニズムや、生体内での役割に焦点を当てて研究を進めることにしたのである。
研究グループはこれまでにもM2マクロファージに関する研究成果として2010年に、エピジェネティックな遺伝子発現制御因子「Jmjd3」が、アレルギー応答や寄生虫感染の際に活性化するM2マクロファージの分化を司っているということを報告している。加えて、最近の研究結果から、ほ乳類の体内にはさまざまな種類のM2マクロファージが存在していることがわかってきている。
今回の研究では、それを受けて、まずは生体内に存在しているすべてのM2マクロファージが、Jmjd3によって制御を受けているかどうかの解析からスタートした。Jmjd3遺伝子を欠損させたマウスを用いて、M2型のマクロファージの1つとして報告されている組織常在型マクロファージについて解析がなされたのである(画像1)。
その結果、Jmjd3が欠損している状況下においても脾臓や肝臓、脂肪組織などの組織常在型マクロファージは正常に存在することが判明。さらに、その遺伝子発現も野生型と比較して同等であることが確認された。このことから研究グループは、組織常在型マクロファージはJmjd3非依存的な分化の経路を辿っている可能性を推測するに至ったというわけだ。
続いて研究グループは、マクロファージを用いたさまざまなDNAマイクロアレイのデータを網羅的に解析。その結果、浮かび上がってきたのが、「Trib2」および「Trib3」と共にTribbleファミリーを形成するTrib1遺伝子である。これらの遺伝子はさまざまな生物種を超えて広く保存されており、Trib1とTrib2は白血病との関連も示唆されているという特徴を持つ。しかし、Trib1と免疫系細胞の分化との関係性については、これまでのところ不明だったのである。
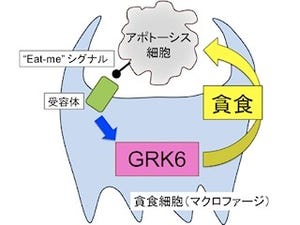
そこで、研究グループは作成したTribbleファミリーの遺伝子を欠損したマウスたち(Trib1-/-、Trib2-/-およびTrib3-/-マウス)を用いて、これらの遺伝子の生体における機能解析を実施した。その結果、Trib1-/-マウスにおいてのみ、組織常在型マクロファージが著明に減弱していることが明らかとなったのである(画像2)。このほか、このTrib1-/-マウスでは免疫細胞の1種「好酸球」が減少しており、同じく免疫細胞の「好中球」はわずかに増加していることも確認された。
次に、研究グループがこれらのマクロファージの遺伝子発現を調べたところ、M2マクロファージが発現している「Arg1」や「Fizz1」などの遺伝子を、「強く」発現していることを確認。しかし、Jmjd3によって分化するタイプのM2マクロファージとは異なるものであったため、研究グループは、これらのマクロファージを組織常在型M2様マクロファージと命名したというわけだ。
免疫系に関与している細胞の分化は、そのほとんどの場合が骨髄で始まり、それらが血流に乗って抹消の組織に移行していくことから、続いては骨髄が調べられた。すると、抹消のさまざまな組織で確認された結果と同じように、Trib1-/-の骨髄でもマクロファージの割合は著明に減弱していたのである。
さらに研究グループは、野生型およびTrib1-/-骨髄細胞を回収し、放射線照射した別のマウスへの骨髄移植を実施。この場合でも同様の結果が得られたことから、Trib1は骨髄細胞側で作用することにより、マクロファージなどの細胞の分化に影響を与えていることが明らかとなった次第だ。
続いて、どのような分子メカニズムによってTrib1が周囲のタンパク質に作用しているのかを明らかにするために、研究グループは野生型とTrib1-/-骨髄細胞とを用いて、「コロニーアッセイ」による調査を行った。コロニーアッセイとは、近年になって、ES細胞やiPS細胞由来の造血幹細胞の分化能を調べるシステムとして頻繁に用いられているシステムで、細胞表面マーカー、遺伝子発現解析では得られない分化能を示すコロニー数やコロニーの種類についての解析結果を得ることが可能だ。その結果、これも抹消器官における結果と一致し、Trib1-/-骨髄からは正常なマクロファージコロニーや好酸球コロニーの出現はほとんど確認できないというものとなったのである。
なおTrib1は、「C末端」側にタンパク質分解に関与する「E3ユビキチンリガーゼ」である「COP1」との結合部位を所持しているという構造的な特徴を持つ。そこで研究グループは、Trib1を欠損させた骨髄細胞に、野生型のTrib1とCOP1結合部位を削った変異型Trib1とを各々再発現させ、それらの細胞を用いたコロニーアッセイを再度実施することにした。
そして、前者の野生型を発現させた細胞ではマクロファージコロニーなどが再発現したが、後者の変異型を発現させた細胞では同コロニーの再発現は観察できないという結果が得られたのである(画像3)。以上の結果から、「Trib1-COP1複合体」は未知の目的遺伝子の発現量を調節することによって、これらの分化に寄与していることが明らかとなった。
さらに実験は進められ、研究グループはそこでTrib1-COP1複合体のターゲットとなっている遺伝子を同定するため、分化に重要であることが報告されている転写因子の発現量について、野生型とTrib1-/-細胞とで網羅的な比較を行った。すると、転写因子「C/EBPα」の発現量がTrib1-/-細胞で上昇していることが確認されたのである。
それを受け、次にTrib1-/-骨髄細胞においてC/EBPαの発現量を低下させた細胞を用いて、RNAi(RNA干渉)の技術を応用したコロニーアッセイが行われた。すると、正常なマクロファージコロニーの再形成が観察されたのである。以上の結果から、Trib1はC/EBPαの発現量をCOP1依存的に調節することによって、マクロファージの分化を司っていることが明らかとなった次第だ。
なお、これまでの報告によると、「全ゲノム相関解析」による結果として、遺伝的にTrib1に変異を所持する患者は脂質代謝に異常をきたすことがわかっている。そこで、研究グループは次にTrib1-/-の脂肪組織の調査を行うことにした。するとTrib1-/-マウスでは、脂肪組織においても組織常在型M2様マクロファージが著明に減弱していることがわかったのである。
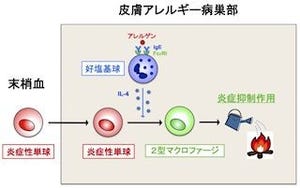
さらにMRIを用いた解析も実施され、Trib1-/-マウスでは、冒頭で述べたようにリポディストロフィーの症状を呈していることが明らかとなった(画像4)。研究グループは、この点について「興味深いこと」と形容している。また、この遺伝子欠損マウスにM2様マクロファージを移植したところ、リポディストロフィーが改善することも確かめられた。リポディストロフィーはM2様マクロファージの欠損から生じること、つまりこの組織常在型M2様マクロファージが脂肪細胞のメンテナンスを行っていることが明らかとなったのである。
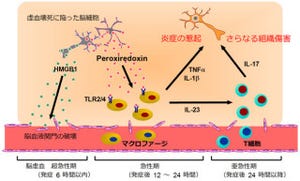
リポディストロフィーの発症は、しばしば重篤なメタボリックシンドロームを発症させてしまうことから、通常の食事下におけるコレステロールや中性脂肪「トリグリセリド(トリアシルグリセロール)」の血中濃度も調べられた。すると、Trib1-/-マウスでは野生型と同程度のものだったが、高脂肪食を与えた場合は値が大きく変化したのである。Trib1-/-マウスは野生型と比較して著しく上昇したほか、糖尿病患者が示す「耐糖能異常」や「インスリン抵抗性」といった病状を呈したのだ(画像5)。またTrib1-/-マウスの脂肪組織では、炎症性サイトカイン「TNFα」の発現が上昇していることも確認された。
以上の結果から高脂肪食下において、Trib1-/-マウスでは、リポディストロフィーを起因とした重度のメタボリックシンドロームの病態を発症していることが明らかとなった次第だ。
これまでマクロファージは、生体内に侵入してきた病原性のバクテリアやウイルスを排除する攻撃的な役割の細胞集団がと考えられてきた。しかし、そうした従来のとらえ方とは対照的に、今回の組織常在型M2様マクロファージは脂肪細胞という抹消組織のメンテナンスを行っていることが明らかとなった。なお、研究グループが以前に報告した、アレルギー反応と深く関与しているJmjd3依存的M2マクロファージのタイプは、脂肪組織などのメンテナンスには関与していないことも今回の研究により判明した。また研究グループによれば、Trib1によって分化してくるM2様マクロファージがアレルゲンに対して正常に応答したことを興味深いことだという。なお以上の研究結果から、ヒトの体内にはさまざまなタイプのM2マクロファージが存在していることが予想されると、研究グループは考察を述べている。
またヒトにおける全ゲノム相関解析から、Trib1に点変異を所持している場合において、代謝疾患を引き起こす可能性があるという報告もあることから、今回のマウスを用いた各種実験によって確かめられたTrib1の作用機序と非常に類似した方法で、ヒトでも機能していることが推測されるという。そうしたことから、この遺伝子発現の調節が代謝疾患を克服するための創薬の新たな切り口となることが考えられるとした。
さらに、がんの転移や浸潤、動脈硬化などの疾患にも、このM2マクロファージの関与が示唆されていることから、各々の疾患に関与するM2マクロファージの分化や活性化、そしてどのようにその疾患にこの細胞が影響を与えているかという作用機序を調べることにより、これらの病態の克服に向けての大いなる1歩を踏み出すことが可能となるとも研究グループはコメントしている。