大阪大学(阪大)は1月30日、緑内障、糖尿病性網膜症と並ぶ後天性の3大失明原因の1つである「網膜色素変性症」の新たな発症メカニズムを発見したと発表した。
成果は、阪大大学院 医学系研究科の野島聡 助教、同・豊福利彦准教授、同・熊ノ郷淳教授(免疫学フロンティア研究センター兼任)、神戸理研CDBの高橋政代プロジェクトリーダー、大阪大学蛋白室研究所の高木淳一 教授らによるもの。研究の詳細な内容は、日本時間1月30日付けで英国科学誌「Nature Communications」に掲載された。
網膜色素変性症は代表的な網膜変性疾患であり、網膜視細胞の進行性の変性を来す眼科疾患で、後天性の3大失明原因の1つとされ、成人の失明の原因として上位を占める重大な疾患であるものの、有効な治療法は現在まで確立されていない。病気の原因としては、いくつかの原因遺伝子が報告されているものの、それらの異常による症例は網膜色素変性症全体の中ではごく一部であり、新たな疾患発症メカニズムの解明と治療法の確立が課題となっている。
研究グループは、これまでの網膜色素上皮に発現するタンパク質「セマフォリン4A(Sema4A)」を欠損させたSema4A遺伝子欠損マウスを用いた研究より、Sema4A欠損下で重度の網膜の視細胞変性を来すことを明らかにしてきたほか、パキスタンの研究グループから、ヒト網膜色素変性症の患者においてSema4Aタンパク質に1アミノ酸変異を有する家系の存在が示唆されていたが、実際にSema4Aタンパク質の1つのアミノ酸の変異で網膜色素変成症が発症するのかどうかは不明のままであった。
研究グループは今回、これらの点突然変異による疾患発症の有無、発症の解明、さらにSema4Aを標的とした疾患治療の有効性の検討を行うことで、こうした課題の解明に挑んだ。
具体的には最初に3種類の点突然変異、「Sema4AD345H」、「Sema4AF350C」、「Sema4A R713Q」が網膜色素変性症の原因となり得るかどうかの検証のために、これらの遺伝子異常を有する遺伝子改変マウス(ノックインマウス)を作成して調査を行った。その結果、変異Sema4AF350Cを有する遺伝子改変マウスが、Sema4A欠損マウスと同程度の重度の視細胞の変性を示したほか、変異Sema4AF350Cが網膜色素変性症の原因となり得ることが動物モデルからも証明された(残る2種類の点突然変異Sema4AD345H、Sema4AR713Qについては、病原性が認められなかったという)。
次に、変異マウスの網膜組織を用いてSema4AF350C変異タンパクの色素上皮細胞における局在の評価を行った結果、Sema4AF350C変異タンパクが本来の局在部位である細胞膜表面に存在せず、細胞質内に留まるという異常な局在パターンを示していることを確認。
また、すでに報告されているヒトSema4Dタンパクの立体構造モデルを元にSema4Aの「立体構造相同モデル」を作成したところ、Sema4AF350C変異の存在する350番目のアミノ酸がSema4Aタンパクの外方に突出した部位に存在しており、その側鎖が内部の空間を埋めていることが示され、これらの結果から、Sema4AタンパクにSema4AF350C変異が生じると、タンパク内部の空間が空洞になってしまい、そのせいでタンパクの立体構造が高度に崩壊し、結果として正常の局在部位である細胞表面へ存在できないということが病態機序であることが示された次第だ。
|
|
|
画像2。Sema4Aタンパク立体構造騒動モデルにおいて、350番目のアミノ酸の位置を図示している。350番目のアミノ酸はタンパクの外方に突出した部分に存在しており、その側鎖は内方へ向き内部の空間を形成している |
研究グループではこれまでの研究として、Sema4A欠損マウスの色素上皮細胞において、「レチノイン酸結合タンパク」および視細胞「プロサポシン」の保護に必須のタンパクの分泌能が著明に障害され、これがSema4A欠損マウスの示す網膜色素変性症の表現型の原因であることを報告しているが、今回の研究では、同様の系を用いてSema4AF350C遺伝子改変マウスについても評価を実施。その結果、網膜色素上皮からのレチノイン酸結合タンパクおよびプロサポシンの分泌はSema4A欠損マウスと同程度に強く障害されていることを確認したという。これは、立体構造の崩壊に伴い正常の局在部位へ存在できないことにより、本来の生理機能が発揮できていないためと考えられると研究グループでは説明している。
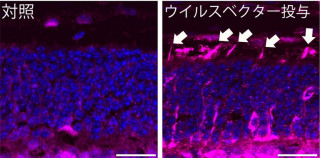
さらに、Sema4Aを標的にしたヒト網膜色素変性症患者に対する遺伝子治療の効果を検討するため、レンチウィルスベクターを用いた遺伝子治療の実験を実施したという。生後1週間の時点において、Sema4A欠損マウスおよびSema4AF350C遺伝子改変マウスに対してウィルス溶液の網膜下注射を行い、色素上皮細胞特異的に野生型Sema4Aタンパクを発現させたところ、本来であれば視細胞が完全に変性・消失してしまうはずの4週齢の時点においても視細胞層は有意に保たれており、Sema4Aを標的とする遺伝子治療について良好な結果が得られたほか、治療効果が少なくとも4カ月間持続していることが確認されたという。
|
|
|
|
画像3(左)が野生型Sema4A遺伝子をSema4A欠損マウスに、画像4が同遺伝子をSema4AF350Cノックインマウスに導入した後の4週齢での網膜組織。野生型Sema4A遺伝子にて遺伝子治療を行うことにより、視細胞の変性が有意に抑制できており、遺伝子治療が成功していると考えられるという |
|
|
|
|
|
画像5(左)がF350C変異Sema4A遺伝子をSema4A欠損マウスに、画像6(右)が同遺伝子をSema4AF350Cノックインマウスに導入した後の4週齢での網膜組織。野生型Sema4A遺伝子のように遺伝子治療効果はない |
|
研究グループでは今回の研究から、4つの発見があったとしている。1つ目は、「慢性的かつ恒常的な酸化ストレスである光刺激」からの網膜保護にSema4Aが必須であること。2つ目は、Sema4Aタンパクの1つのアミノ酸変異により網膜色素変性症を発症すること。3つ目は、Sema4A変異による網膜色素変成症発症が、Sema4Aタンパクの立体構造の崩壊に起因すること。そして最後の4つ目は、Sema4Aの遺伝子治療が網膜色素変性症に対する有効な治療法の1つとなり得ることを証明したことだという。
これらの成果は、網膜色素変性症の新たな病態メカニズムを明らかにすると共に、網膜色素変性症に対する治療法につながるものであることから研究グループでは今後、パキスタン以外の網膜色素変成症家系におけるSema4A変異の検索ならびに網膜色素変性症の早期診断・早期治療への応用に関する検討・検証を進めていく必要があるとするほか、近年の研究からSema4Aがさまざまな網膜保護物質の分泌に関わっていることが判明してきたことから、ほかの遺伝的素因による網膜色素変性症に対してもSema4Aを用いた遺伝子治療が奏功する可能性も出てきたとしている。